吸热反应和放热反应 知识点
吸热反应和放热反应:根据反应过程中能量的变化,将反应分为吸热反应和放热反应,由于反应物和生成物的能量不同,导致反应吸热或放热。反应物的能量高于生成物的能量即是放热反应,生成物的能量高于反应物的能量即是吸热反应。
吸热反应和放热反应 知识点题库
下列变化中生成物的总能量小于反应物的总能量的是( )
A . 灼热的炭与CO2反应
B . H﹣Cl→H+Cl
C . H2SO4+2NaOH=Na2SO4+2H2O
D . C(s)+H2O(g)=CO(g)+H2(g)
下列反应中反应物键能总和高于生成物键能总和的是( )
A . 碳酸钙受热分解
B . 乙醇的燃烧
C . 铝粉与氧化铁粉末反应
D . 氧化钙与水反应
已知:H2(g)+O2(g)═H2O(g),反应过程中能量变化如右图,
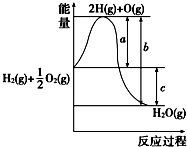
-
(1) a、b、c分别代表什么意义?
a;b;c.
-
(2) 该反应是放热反应还是吸热反应?.
△H大于零还是小于零?.
-
(3) 若已知2H2(g)+O2(g)═2H2O(g)△H1=﹣Q1kJ•mol﹣1;2H2(g)+O2(g)═2H2O(l)△H2=﹣Q2 kJ•mol﹣1 , 则△H1△H2 . (填“>”、“<”或“=”)
-
(4) 发射卫星时可用肼(N2H4)作燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气.已知:N2(g)+2O2(g)═2NO2(g)△H1=+67.7 kJ/mol;N2H4(g)+O2(g)═N2(g)+2H2O(g)△H2=﹣534 kJ/mol.试计算1 mol 肼和二氧化氮完全反应时放出的热量为kJ;写出肼与二氧化氮反应的热化学方程式:.
下列反应中是吸热反应的是( )
A . 碳酸钙受热分解
B . 乙醇燃烧
C . 铝粉与氧化铁粉末反应
D . 氧化钙溶于水
对于放热反应Zn+H2SO4=ZnSO4+H2↑,下列叙述正确的是( )
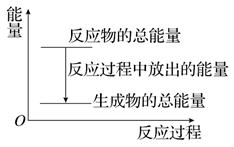
A . 反应过程中的能量关系可用上图表示
B . 1 mol Zn的能量大于1 mol H2的能量
C . 若将其设计为原电池,则锌作正极
D . 若将其设计为原电池,当有32.5 g Zn溶解时,正极放出的气体一定为11.2 L
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化,下列说法中正确的是( )
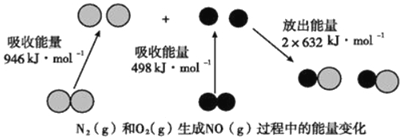
A . 1mol N2(g)和1mol O2(g)完全反应放出的能量为180kJ
B . 通常情况下,N2(g)和O2(g)混合能直接生成NO
C . 1mol N2(g)和1mol O2(g)具有的总能量小于2mol NO(g)具有的总能量
D . NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水
一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中  和
和  代表不同元素的原子。
代表不同元素的原子。
 和
和  代表不同元素的原子。
代表不同元素的原子。
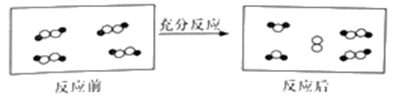
关于此反应说法错误的是( )
A . 一定属于吸热反应
B . 一定属于可逆反应
C . 一定属于氧化还原反应
D . 一定属于分解反应
下列属于吸热反应的是( )
A . Ba(OH)2·8H2O晶体与NH4Cl晶体反应
B . 铝热反应
C . 稀硫酸与烧碱反应
D . 生石灰与水反应
-
(1) Ⅰ、反应A(g)+B(g)
 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题. 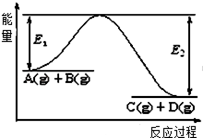
该反应是反应(填“吸热”、“放热”)。
-
(2) 当反应达到平衡时,升高温度,A的转化率(填“增大”、“减小”、“不变”)。
-
(3) 反应体系中加入催化剂对反应热是否有影响?(填“有”、“无”),原因是。
-
(4) 在反应体系中加入催化剂,反应速率增大,E1的变化是:E1(填“增大”、“减小”、“不变”)。
-
(5) Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)
 PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2 , 一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2 , 一段时间后反应达平衡状态,实验数据如下表所示: t/s
0
50
150
250
350
n(PCl5)/mol
0
0.24
0.36
0.40
0.40
50~150s内的平均反应速率v(PCl3)=。
-
(6) 该温度下,此反应的化学平衡常数的数值为。
-
(7) 反应至250s时,该反应放出的热量为kJ。
-
(8) 下列关于上述反应的说法中,正确的是(填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.2molPCl3、0.5molCl2 和0.15mol PCl5 , 则反应向正反应方向进行
700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)⇌CO2(g)+H2(g)反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | N(CO)/mol | N(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | 0.20 |
下列说法正确的是( )
A . 反应在t1min内的平均速率为v(H2)= 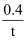 mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
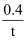 mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
mol•L-1•min
B . 保持其他条件不变,起始时向容器中充入0.60molCO和1.20mol H2O,达到平衡时n(CO2)=0.40mol
C . 保持其他条件不变,向平衡体系中再通入0.20molH2O,与原平衡相比,达到新平衡时CO转化率不变,H2O的体积分数不变
D . 温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
下列叙述正确的是( )
A . 等质量的硫蒸气和硫粉分别完全燃烧,后者放出热量多
B . 稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-53.7 kJ·mol-1 , 若将含1 mol H2SO4的稀溶液与含0.5 mol Ba(OH)2的溶液混合,放出的热量则为57.3 kJ
C . C(石墨,s)=C(金刚石,s) ΔH=+1.9 kJ·mol-1 , 则说明石墨比金刚石稳定
D . X(g)+Y(g)  Z(g) △H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大
Z(g) △H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大
 Z(g) △H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大
Z(g) △H>0,恒温恒容条件下达到平衡后加入X,上述反应△H增大
某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中p表示压强,T表示温度,n表示物质的量)。
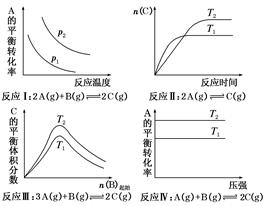
根据以上规律判断,下列结论正确的是( )
A . 反应Ⅰ:ΔH>0,p2>p1
B . 反应Ⅱ:ΔH<0,T1<T2
C . 反应Ⅲ:ΔH>0,T2>T1或ΔH<0,T2<T1
D . 反应Ⅳ:ΔH<0,T2>T1
某反应M→N,它的反应能量曲线如反应过程如图所示,下列有关叙述正确的是( )
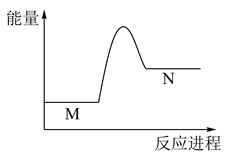
A . NaHCO3和盐酸的反应能量变化类型与该反应相同
B . 物质N比M更稳定
C . 该反应生成是放热反应
D . 该反应实现了化学能转化为热能
下列诗句或谚语中包含吸热反应过程的是( )
A . 野火烧不尽,春风吹又生
B . 春蚕到死丝方尽,蜡炬成灰泪始干
C . 千锤万凿出深山,烈火焚烧若等闲
D . 爆竹声中一岁除,春风送暖入屠苏
已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的( )
A . X的能量一定低于M
B . Y的能量一定高于N
C . 1molX和1molY的总能量一定高于1molM和1molN的总能量
D . 因该反应为放热反应,故不必加热就可发生
1868年狄肯和洪特发明了用空气中的氧气来氧化氯化氢气体制取氯气的方法:4HCl(g)+O2(g)=2Cl2(g)+2H2O(g)。化学反应与能量变化的关系如图所示,下列说法中不正确的是( )
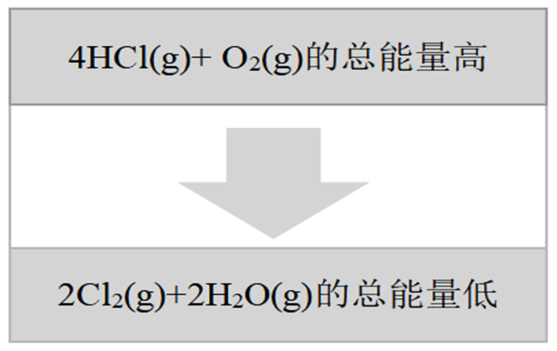
A . 该反应为放热反应
B . 若H2O为液态,则生成物总能量将变小
C . 4HCl(g)和O2(g)总能量高于2Cl2(g)和2H2O(g)的总能量,反应时向环境释放能量
D . 断开旧化学键吸收的总能量大于形成新化学键所释放的总能量
如图所示,在锥形瓶中放入一支试管,试管中加入下列物质中的一种:①NaOH固体、②生石灰、③ 晶体、④
晶体、④ 固体、⑤
固体、⑤ 粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( )
粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( )
 晶体、④
晶体、④ 固体、⑤
固体、⑤ 粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( )
粉末。U形玻璃管中盛有品红溶液,开始时溶液两端高度一致,用胶头滴管向试管中加入适量水,U形玻璃管中的品红溶液呈现如图状态,判断试管中加入的物质可能是( )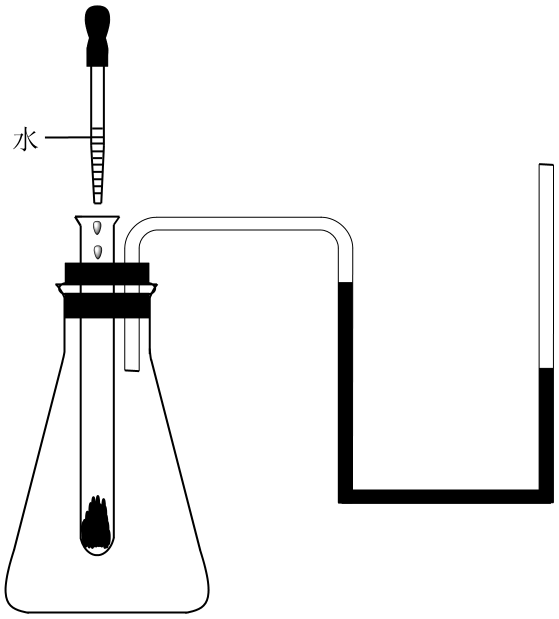
A . ①②④
B . 只有③
C . ③⑤
D . 全部
下列说法中正确的是( )
A . 吸热反应一定需要加热才能反应,而放热反应在常温下一定能进行
B . 水银和生铁都属于纯金属
C . 用铂丝蘸取某碱金属的盐溶液灼烧,火焰呈黄色,证明其中含有 D . 某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵
D . 某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵
 D . 某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵
D . 某硫酸铵肥料中只含一种杂质,氮元素的质量分数为20%,可能混有硝酸铵
“神舟十三号”乘组航天员在空间站进行了三次“天宫授课”。以下实验均在太空中进行,下列说法正确的是( )
A . “泡腾片实验”中,柠檬酸与小苏打反应时,有电子的转移
B . “太空冰雪实验”中,过饱和乙酸钠溶液结晶,该过程放出热量
C . “太空五环实验”中,向乙酸溶液中滴加甲基橙溶液后变成黄色
D . “水油分离实验”中,不需其他操作,静置即可实现水和油的分离
为了研究化学反应A+B=C+D的能量变化情况,某同学设计了如图所示装置。当向盛有A的试管中滴加试剂B时,看到U形管中甲处液面下降乙处液面上升。回答下列问题:
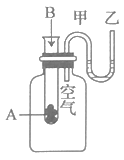
-
(1) 该反应为(填“放热”或“吸热”)反应。
-
(2) 反应物A和B的总能量比生成物C和D的总能量(填“高”或低”)。
-
(3) 该反应过程中,物质中的能通过化学反应转化成能释放出来。
-
(4) 该反应过程中,反应物化学键断裂吸收的能量(填“高”或“低”)于生成物化学键形成放出的能量。
-
(5) 下列反应符合题中实验现象的是____(填标号)。A . 2Al+6HCl=2AlCl3+3H2↑ B . 2Na+2H2O=2NaOH+H2↑ C . NaOH+HCl=NaCl+H2O D . Na2O2+2CO2=2Na2CO3+O2
最近更新



