吸热反应和放热反应 知识点题库
下列关于热化学反应的描述中正确的是( )
A . HCl和NaOH反应的中和热△H=﹣57.3 kJ•mol﹣1 , 则H2SO4和Ca(OH)2反应的中和热△H=﹣114.6kJ•mol﹣1
B . 已知CO(g)的燃烧热是283.0 kJ•mol﹣1 , 则2CO2(g)=2CO(g)+O2(g)△H=+566.0 kJ•mol﹣1
C . 需要加热才能发生的反应一定是吸热反应
D . 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量就是甲烷的燃烧热
下列说法不正确的是( )
A . 需要加热方能发生的反应不一定是吸热反应
B . 反应是吸热还是放热取决于反应物和生成物所具有的总能量的相对大小
C . 测定中和反应的反应热时,酸碱中和之后应读取体系达到的最高温度
D . 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
下列图示与对应的叙述不正确的是( )
A .  图可表示短周期主族元素的原子半径随原子序数的变化规律
B .
图可表示短周期主族元素的原子半径随原子序数的变化规律
B .  图可表示第二周期主族元素最外层电子数随原子序数的变化规律
C .
图可表示第二周期主族元素最外层电子数随原子序数的变化规律
C . 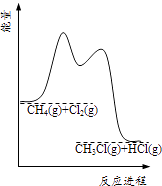 图可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D .
图可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D .  图可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2 时间:v(正反应)=v(逆反应)≠0
图可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2 时间:v(正反应)=v(逆反应)≠0
 图可表示短周期主族元素的原子半径随原子序数的变化规律
B .
图可表示短周期主族元素的原子半径随原子序数的变化规律
B .  图可表示第二周期主族元素最外层电子数随原子序数的变化规律
C .
图可表示第二周期主族元素最外层电子数随原子序数的变化规律
C .  图可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D .
图可表示CH4与Cl2经两步反应生成CH3Cl,则两步反应均为放热反应
D .  图可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2 时间:v(正反应)=v(逆反应)≠0
图可表示一定条件下,合成氨反应正、逆反应速率随时间的变化,则t1~t2 时间:v(正反应)=v(逆反应)≠0
下列反应既属于氧化还原反应,又是吸热反应的是( )
A . 钠与冷水的反应
B . 甲烷在氧气中的燃烧反应
C . 灼热的木炭与CO2反应
D . Ba(OH)2•8H2O晶体与NH4Cl晶体的反应
下列关于反应能量的说法正确的是( )
A . 已知C(石墨,s)=C(金刚石,s);△H>0,则金刚石比石墨稳定
B . 相同条件下,如果1mol氢原子所具有的能量为E1 , 1mol氢分子所具有的能量为E2 , 则2E1>E2
C . 101kPa时,2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJ•mol﹣1 , H2的燃烧热为571.6kJ•mol﹣1
D . H+(aq)+OH﹣(aq)=H2O(l);△H=﹣57.3 kJ•mol﹣1 , 含1molNaOH的氢氧化钠溶液与含0.5molH2SO4的浓硫酸混合后放出57.3kJ的热量
某可逆反应过程的能量变化如图所示,下列说法正确的是( )
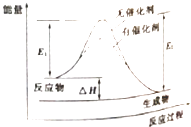
A . 该反应能量变化类型与CaCO3分解反应相同
B . 加催化剂后,正反应速率加快,逆反应速率减小
C . 若该反应为氧化还原反应,则可以将其设计成原电池
D . 反应热△H=E2﹣E1
下列说法正确的是( )
A . 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2 , 分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度
B . 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L﹣1下降到0.03 mol•L﹣1 , 该双氧水在这2h中分解的平均反应速率约为0.015 mol•L﹣1•h﹣1
C . 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢
D . 一定条件下,固定体积的容器中发生反应A(g)+B(g)⇌2C(g),当容器内A,B,C的浓度之比为1:1:2时,该反应一定处于平衡状态
下列图示变化表示吸热反应的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
已知金刚石在一定条件下转化为石墨是放热的.据此以下说法正确的是( )
A . 需要加热方能发生的反应一定是吸热反应
B . 放热反应在常温下一定很容易发生
C . 反应是放热还是吸热,须看反应物和生成物所具有的总能量的相对大小
D . 金刚石比石墨稳定
图象能直观地反映有关物理量的变化及规律,下列各图象与描述相符的是( )
A . 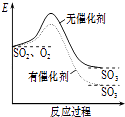 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B .
如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B . 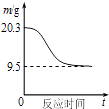 如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C .
如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C .  如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL
D .
如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL
D . 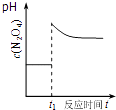 如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
 如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B .
如图表示SO2氧化反应分别在有、无催化剂的情况下反应过程中的能量变化
B .  如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C .
如图表示0.1molMgCl2•6H2O在空气中充分加热时固体质量随时间的变化
C .  如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL
D .
如图表示分别稀释1mLpH=2的盐酸和醋酸时溶液pH的变化,图中b>100mL
D .  如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
如图表示平衡2NO2(g)⇌N2O4(g)在t1时迅速将体积缩小后c(N2O4)的变化
我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
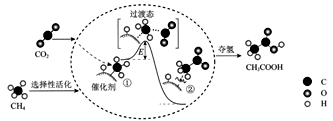
则下列说法错误的是( )
A . 生成CH3COOH总反应是化合反应
B . ①→②过程形成了C―C键
C . CH4→CH3COOH过程中,有C―H键发生断裂
D . ①→②吸收能量
下列图像分别表示有关反应的反应过程与能量变化的关系。

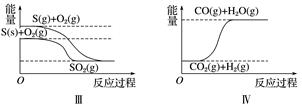
据此判断下列说法中正确的是( )
A . 石墨转变为金刚石是吸热反应
B . 白磷比红磷稳定
C . S(g)+O2(g)=SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2
D . CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
下列变化中生成物的总能量大于反应物的总能量的是( )
A . 氢氧化钡晶体与氯化铵晶体混合
B . 铝热反应
C . 木炭在氧气中发生不完全燃烧
D . 生石灰和水的反应
热催化合成氨面临的两难问题是:采用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了Ti-H-Fe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
A . ①为N  N的断裂过程
B . ① ③在高温区发生,②④⑤在低温区发生
C . ④为N原子由Fe区域向Ti-H区域的传递过程
D . 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
N的断裂过程
B . ① ③在高温区发生,②④⑤在低温区发生
C . ④为N原子由Fe区域向Ti-H区域的传递过程
D . 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
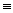 N的断裂过程
B . ① ③在高温区发生,②④⑤在低温区发生
C . ④为N原子由Fe区域向Ti-H区域的传递过程
D . 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
N的断裂过程
B . ① ③在高温区发生,②④⑤在低温区发生
C . ④为N原子由Fe区域向Ti-H区域的传递过程
D . 使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
下列说法错误的是( )
A . 在化学反应中,随着物质的变化,既有化学键的断裂,又有化学键的形成,还有化学能的改变
B . 化学反应过程中是放出热量还是吸收热量,取决于反应物的总能量与生成物的总能量的相对大小
C . 需要加热才能发生的化学反应,则该反应进行后一定是吸收热量的
D . 物质具有的能量越低,其稳定性越大,反应越难以发生;物质具有的能量越高,其稳定性越小,反应越容易发生
如图表示水中c(H+)和c(OH-)的关系。下列判断正确的是( )
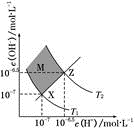
A . 图中T1>T2
B . XZ线上任意点均有pH<7
C . 两条曲线间任意点均有c(H+)×c(OH+)=Kw=1×10-13
D . M区域内任意点对应的溶液中下列离子均可大量共存:S2-、SO42-、Na+、Cl-
下列变化过程,属于放热反应的是( )
① 液态水变成水蒸气 ② 酸碱中和反应 ③ 浓H2SO4稀释 ④ 固体NaOH溶于水 ⑤ H2在Cl2中燃烧 ⑥ 弱酸电离
A . ②③④⑤
B . ②③④
C . ②⑤
D . ①③⑤
回答下列问题:
-
(1) 下列反应属于放热反应的是_______。A . 铝片与稀H2SO4反应制取H2 B . 碳酸钙高温分解成氧化钙和二氧化碳 C . 葡萄糖在人体内氧化分解 D . Ba(OH)2·8H2O与NH4Cl固体反应
-
(2) 一定条件下,2L密闭容器中SO2与O2反应5min后,若SO2和SO3物质的量分别为0.1 mol和0.3mol,则SO2起始物质的量浓度为;用O2表示这段时间该化学反应速率为。
-
(3) 用活性炭还原法处理氮氧化物。有关反应为C(s)+2NO(g)
 N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A . 活性炭的质量保持不变 B . v正(N2)=2v逆(NO) C . 容器内气体压强保持不变 D . 容器内混合气体的密度保持不变 E . 容器内混合气体的平均相对分子质量保持不变 F . 容器内CO2的浓度保持不变
N2(g)+CO2(g),某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,下列说法不能作为判断该反应达到化学平衡状态标志的是________(填选项字母)
A . 活性炭的质量保持不变 B . v正(N2)=2v逆(NO) C . 容器内气体压强保持不变 D . 容器内混合气体的密度保持不变 E . 容器内混合气体的平均相对分子质量保持不变 F . 容器内CO2的浓度保持不变 -
(4) 利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能利用化学能,装置如图所示:
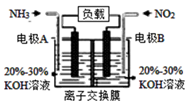
①A电极的电极反应式为。
②下列关于该电池的说法正确的是(填选项字母)。
A.电子从右侧电极经过负载后流向左侧电极 B.离子交换膜为阴离子交换膜,则OH-由右侧溶液移向左侧溶液 C.当有4.48L NO2被处理时,转移电子的物质的量为0.8mol
-
(5) 从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。已知: 1molN2和3molH2反应生成2molNH3时放出热量93kJ,试根据表中所列键能数据计算a的数值。
化学键
H—H
N—H
N≡N
键能kJ/mol
436
a
945
关于热化学方程式2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l) △H= -11036kJ/mol的能量。下列叙述错误的是( )
A . 该反应断开旧化学键吸收的总能量低于形成新化学键所释放出的总能量
B . 在25℃,101kPa时的C8H18燃烧热为5518kJ/mol
C . 2moC8H18(l)完全燃烧生成气态水放出的热量高于11036kJ
D . 该反应在低温下有可能自发进行
关于化学反应与能量的说法正确的是( )
A . 任何化学反应都伴随有能量变化
B . ΔH>0表示放热反应,ΔH<0表示吸热反应
C . 化学键的断裂会放出能量
D . 反应物总能量比生成物总能量高的反应是吸热反应
最近更新



