еҗёзғӯеҸҚеә”е’Ңж”ҫзғӯеҸҚеә” зҹҘиҜҶзӮ№йўҳеә“
 B .
B .  C .
C . 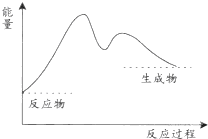 D .
D . 

-
пјҲ1пјү еӣҫв… дёӯеҸ‘з”ҹеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҢе®һйӘҢдёӯжё©еәҰи®ЎжҢҮзӨәзҡ„жё©еәҰеҸҳеҢ–еҸҠе…¶еҺҹеӣ жҳҜ
-
пјҲ2пјү еӣҫв…Ўе®һйӘҢзҡ„е®һйӘҢзҺ°иұЎеҰӮиЎЁпјҢиҜ·е®ҢжҲҗзӣёеә”е®һйӘҢзҺ°иұЎзҡ„и§ЈйҮҠпјҺ
е®һйӘҢзҺ°иұЎ
и§ЈйҮҠеҺҹеӣ
CuзүҮдёҠдә§з”ҹдәҶеӨ§йҮҸж°”жіЎ
жё©еәҰи®ЎжҢҮзӨәзҡ„жё©еәҰж— жҳҺжҳҫеҸҳеҢ–
-
пјҲ3пјү иӢҘе°Ҷеӣҫдёӯзҡ„CuзүҮжӣҝжҚўдёәFeзүҮпјҢеҲҷFeзүҮдёҠзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҺ
X | Y | Z | |
A | й’ е…ғзҙ | дё»ж—Ҹе…ғзҙ | зҹӯе‘Ёжңҹе…ғзҙ |
B | з”өи§ЈиҙЁ | еҢ–еҗҲзү© | зәҜеҮҖзү© |
C | ж°ўж°§еҢ–й“Ғ | иғ¶дҪ“ | еҲҶж•Јзі» |
D | зҪ®жҚўеҸҚеә” | ж°§еҢ–иҝҳеҺҹеҸҚеә” | ж”ҫзғӯеҸҚеә” |

 2SO3(g) О”H=a kJВ·mol-1 пјҢ еҸҚеә”иғҪйҮҸеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү
2SO3(g) О”H=a kJВ·mol-1 пјҢ еҸҚеә”иғҪйҮҸеҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү 

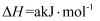 гҖӮпјҲеңЁжҹҗе®№еҷЁдёӯпјҢе……е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„
гҖӮпјҲеңЁжҹҗе®№еҷЁдёӯпјҢе……е…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„  е’Ң
е’Ң  пјүдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
пјүдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү 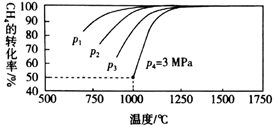
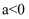 B . еҺӢејәе…ізі»пјҡ
B . еҺӢејәе…ізі»пјҡ 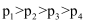 C . жҒ’жё©гҖҒжҒ’еҺӢжқЎд»¶дёӢпјҢе……е…Ҙ
C . жҒ’жё©гҖҒжҒ’еҺӢжқЎд»¶дёӢпјҢе……е…Ҙ 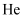 пјҢе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ
D .
пјҢе№іиЎЎеҗ‘йҖҶеҸҚеә”ж–№еҗ‘移еҠЁ
D . 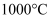 ж—¶зҡ„е№іиЎЎеёёж•°
ж—¶зҡ„е№іиЎЎеёёж•° 
-
пјҲ1пјү еҲ©з”ЁеҸҚеә”2NO(g)+2CO(g)=N2(g)+2CO2(g)пјҢеҸҜе®һзҺ°жұҪиҪҰе°ҫж°”зҡ„ж— е®іеҢ–еӨ„зҗҶгҖӮдёҖе®ҡжқЎд»¶дёӢиҝӣиЎҢиҜҘеҸҚеә”пјҢжөӢеҫ—COзҡ„е№іиЎЎиҪ¬еҢ–зҺҮдёҺжё©еәҰгҖҒиө·е§ӢжҠ•ж–ҷжҜ”m[m=
 ]зҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәгҖӮ
]зҡ„е…ізі»еҰӮеӣҫ1жүҖзӨәгҖӮ 
в‘ иҜҘеҸҚеә”зҡ„О”H0(еЎ«вҖң>вҖқгҖҒвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ
в‘ЎжҠ•ж–ҷжҜ”m1гҖҒm2гҖҒm3дёӯпјҢжңҖеӨ§зҡ„жҳҜгҖӮ
в‘ўйҡҸзқҖжё©еәҰзҡ„еҚҮй«ҳпјҢдёҚеҗҢжҠ•ж–ҷжҜ”дёӢCOе№іиЎЎиҪ¬еҢ–зҺҮи¶ӢдәҺзӣёиҝ‘зҡ„еҺҹеӣ жҳҜгҖӮ
-
пјҲ2пјү е·Ҙдёҡз”ҹдә§жҺ’ж”ҫзҡ„зғҹж°”дёӯеҗҢж—¶еӯҳеңЁSO2гҖҒNOxе’ҢCOпјҢеҲ©з”Ёе®ғ们зҡ„зӣёдә’дҪңз”ЁеҸҜе°ҶSO2гҖҒNOxиҝҳеҺҹжҲҗж— е®ізү©иҙЁпјҢдё»иҰҒеҸҚеә”жңүпјҡ
2CO(g)+2NO(g)=2CO2(g)+N2(g)О”H=akJВ·mol-1
4CO(g)+2NO2(g)=4CO2(g)+N2(g)О”H=bkJВ·mol-1
4CO(g)+2SO2(g)=4CO2(g)+S2(g)О”H=ckJВ·mol-1
еҲҷ2NO2(g)+S2(g)=N2(g)+2SO2(g)зҡ„О”H=kJВ·mol-1гҖӮ
-
пјҲ3пјү NH3еӮ¬еҢ–иҝҳеҺҹж°®ж°§еҢ–зү©жҳҜзӣ®еүҚеә”з”ЁжңҖе№ҝжіӣзҡ„зғҹж°”и„ұзЎқжҠҖжңҜгҖӮз”Ёжҙ»еҢ–еҗҺзҡ„V2O5дҪңеӮ¬еҢ–еүӮпјҢNH3е°ҶNOиҝҳеҺҹжҲҗN2зҡ„дёҖз§ҚеҸҚеә”еҺҶзЁӢеҰӮеӣҫ2жүҖзӨәпјҢеҲҷжҖ»еҸҚеә”ж–№зЁӢејҸдёәгҖӮ

-
пјҲ4пјү з”Ёй—ҙжҺҘз”өеҢ–еӯҰжі•еҺ»йҷӨзғҹж°”дёӯNOзҡ„еҺҹзҗҶеҰӮеӣҫ3жүҖзӨәгҖӮPtйҳҙжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәгҖӮ

|
е…ұд»·й”® |
H-H й”® |
NдёүNй”® |
N-H й”® |
|
й”®иғҪ(kJ/mo1) |
436 |
945 |
391 |
е·ҘдёҡеҗҲжҲҗж°Ёзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ N2+3H2  2NH3
2NH3
-
пјҲ1пјү ж–ӯејҖ1mol N2дёӯзҡ„еҢ–еӯҰй”®йңҖ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңж”ҫеҮәвҖқ) kJ иғҪйҮҸпјӣ
-
пјҲ2пјү еҪўжҲҗ2mol NH3дёӯзҡ„еҢ–еӯҰй”®йңҖ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңж”ҫеҮәвҖқ)kJ иғҪйҮҸпјӣ
-
пјҲ3пјү еңЁ298 Kж—¶пјҢеҸ–1mol N2е’Ң3 mol H2ж”ҫе…ҘдёҖеҜҶй—ӯе®№еҷЁдёӯпјҢеңЁеӮ¬еҢ–еүӮеӯҳеңЁдёӢиҝӣиЎҢеҸҚеә”гҖӮзҗҶи®әдёҠж”ҫеҮәжҲ–еҗёж”¶зҡ„зғӯйҮҸдёәQ1 пјҢ еҲҷQ1дёәkJгҖӮж №жҚ®дёҠиЎЁдёӯзҡ„ж•°жҚ®еҲӨж–ӯе·ҘдёҡеҗҲжҲҗж°Ёзҡ„еҸҚеә”жҳҜ(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”гҖӮ
е®һйӘҢв‘ пјҡеңЁиЈ…зҪ®в‘ дёӯеҠ е…Ҙ40mL1mol/Lзҡ„зЎ«й…ё
е®һйӘҢв‘ЎпјҡеңЁиЈ…зҪ®в‘ЎдёӯеҠ е…Ҙ40mL4mol/Lзҡ„зЎ«й…ёгҖӮ
жҜ”иҫғдәҢиҖ…收йӣҶ10mLH2ж—¶жүҖз”Ёзҡ„ж—¶й—ҙгҖӮ

-
пјҲ1пјү еҪ“收йӣҶеҲ°10mLH2ж—¶пјҢе“ӘдёӘе®һйӘҢжүҖиҖ—ж—¶й—ҙиҫғй•ҝпјҹ (еЎ«еҶҷе®һйӘҢеәҸеҸ·)дёәд»Җд№ҲпјҹгҖӮ
-
пјҲ2пјү жҙ»еЎһеӨ–移зҡ„жғ…еҶөжҳҜгҖӮ
AпјҺеқҮеҢҖеӨ–移 BпјҺе…Ҳеҝ«еҗҺж…ў CпјҺе…Ҳж…ўеҗҺеҝ« DпјҺе…Ҳж…ўеҗҺеҝ«пјҢ然еҗҺеҸҲйҖҗжёҗеҮҸж…ўпјҢдҪ йҖүжӢ©зҡ„зҗҶз”ұжҳҜгҖӮ
| | | | |
| AпјҺеҸҚеә”зү©жҖ»иғҪйҮҸеӨ§дәҺз”ҹжҲҗзү©жҖ»иғҪйҮҸ | BпјҺеҸҚеә”ејҖе§ӢеҗҺпјҢй’Ҳзӯ’жҙ»еЎһеҗ‘еҸіз§»еҠЁ | CпјҺеҸҚеә”ејҖе§ӢеҗҺпјҢз”ІеӨ„ж¶ІйқўдҪҺдәҺд№ҷеӨ„ж¶Ійқў | DпјҺжё©еәҰи®Ўзҡ„ж°ҙ银жҹұдёҚж–ӯдёҠеҚҮ |
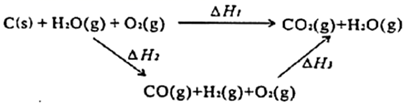
 B .
B .  C .
C .  D .
D . 
-
пјҲ1пјү еҲҶжһҗдёӢйқўзҡ„иғҪйҮҸеҸҳеҢ–еӣҫпјҢеҲҷC(s)+H2O(g)=CO(g)+H2(g)дёә(еЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқ)еҸҚеә”гҖӮдёӢеҲ—еҢ–еӯҰеҸҚеә”зҡ„иғҪйҮҸеҸҳеҢ–дёҺC(s)+H2O(g)=CO(g)+H2(g)зҡ„иғҪйҮҸеҸҳеҢ–зӣёеҗҢзҡ„жҳҜ(еЎ«ж ҮеҸ·)гҖӮ

AпјҺзЁҖзЎ«й…ёдёҺNaOHжә¶ж¶Ізҡ„еҸҚеә” BпјҺзӮ№зҮғзҡ„й•ҒжқЎеңЁж°®ж°”дёӯ继з»ӯзҮғзғ§
CпјҺзҒјзғӯзҡ„зӮӯдёҺдәҢж°§еҢ–зўізҡ„еҸҚеә” DпјҺBa(OH)2В·8H2OдёҺNH4Clзҡ„еҸҚеә”
-
пјҲ2пјү ж–ӯиЈӮ1molHвҖ”Hй”®гҖҒ1molNвҖ”Hй”®гҖҒ1molNвүЎNй”®еҲҶеҲ«йңҖиҰҒзҡ„иғҪйҮҸжҳҜ436kJгҖҒ391kJгҖҒ946kJпјҢеҲҷз”ҹжҲҗ2molNH3ж”ҫеҮәзҡ„зғӯйҮҸдёәkJгҖӮ
-
пјҲ3пјү еңЁжё©еәҰдёҚеҸҳзҡ„жқЎд»¶дёӢпјҢеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”2SO2(g)+O2(g)
 2SO3(g)гҖӮ
2SO3(g)гҖӮв‘ жҒ’е®№жқЎд»¶дёӢпјҢO2зҡ„жө“еәҰеңЁ2minеҶ…з”ұ0.4mol/LеҸҳжҲҗ0.1mol/LпјҢеҲҷз”ұSO2иЎЁзӨәзҡ„иҝҷж®өж—¶й—ҙеҶ…еҸҚеә”зҡ„е№іеқҮйҖҹзҺҮдёәmol/(LВ·min)гҖӮ
в‘ЎиӢҘеҺӢзј©ж°”дҪ“дҪ“з§Ҝд»ҘеўһеӨ§еҺӢејәпјҢеҲҷиҜҘеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮе°Ҷ(еЎ«вҖңеҠ еҝ«вҖқгҖҒвҖңеҮҸж…ўвҖқжҲ–вҖңдёҚеҸҳвҖқ)гҖӮ
-
пјҲ4пјү дёҖе®ҡжё©еәҰдёӢпјҢеңЁе®№з§Ҝдёә1.0Lзҡ„жҒ’е®№еҜҶй—ӯе®№еҷЁдёӯж”ҫе…Ҙ0.10molPCl5(g)пјҢеңЁдёҖе®ҡжё©еәҰдёӢиҝӣиЎҢеҸҚеә”пјҡPCl5(g)
 PCl3(g)+Cl2(g)пјҢиҜҘеҸҚеә”дёәеҗёзғӯеҸҚеә”пјҢеҸҚеә”ж—¶й—ҙ(t)дёҺе®№еҷЁеҶ…ж°”дҪ“жҖ»еҺӢејә(p)зҡ„ж•°жҚ®и§ҒиЎЁпјҡ
PCl3(g)+Cl2(g)пјҢиҜҘеҸҚеә”дёәеҗёзғӯеҸҚеә”пјҢеҸҚеә”ж—¶й—ҙ(t)дёҺе®№еҷЁеҶ…ж°”дҪ“жҖ»еҺӢејә(p)зҡ„ж•°жҚ®и§ҒиЎЁпјҡt/h
0
1
2
4
8
16
20
25
30
p/100kPa
4.91
5.58
6.32
7.31
8.54
9.50
9.52
9.53
9.53
в‘ дёҠиҝ°еҸҚеә”дҪ“зі»еӨ„дәҺеҢ–еӯҰе№іиЎЎзҠ¶жҖҒзҡ„ж—¶й—ҙж®өжҳҜ(еЎ«вҖң4~8вҖқгҖҒвҖң16~20вҖқвҖң20пҪһ25вҖқжҲ–вҖң25~30вҖқ)hгҖӮ
в‘ЎдёӢеҲ—еҸҜд»ҘиҜҙжҳҺиҜҘеҸҚеә”иҫҫеҲ°е№іиЎЎзҡ„жҳҜ(еЎ«ж ҮеҸ·)гҖӮ
AпјҺc(PCl5)пјҡc(PCl3)пјҡc(Cl2)=1пјҡ1пјҡ1 BпјҺv(PCl5)=v(PCl3)
CпјҺе®№еҷЁеҶ…ж°”дҪ“зҡ„йўңиүІдёҚеҶҚеҸҳеҢ– DпјҺж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдёҚеҶҚеҸҳеҢ–
в‘ўз»“еҗҲдёҠиҝ°иҪ¬еҢ–зҡ„еҢ–еӯҰж–№зЁӢејҸпјҢиҜҙжҳҺеңЁжҒ’жё©жҒ’е®№жқЎд»¶дёӢеҸҚеә”дҪ“зі»еҺӢејәеўһеӨ§зҡ„еҺҹеӣ пјҡгҖӮ
в‘Јз”ЁжҖ»еҺӢејәpе’Ңиө·е§ӢеҺӢејәp0и®Ўз®—еҸҚеә”зү©PCl5зҡ„е№іиЎЎиҪ¬еҢ–зҺҮпјҢеҲҷОұ(PCl5)=(дҝқз•ҷдёүдҪҚжңүж•Ҳж•°еӯ—)гҖӮ







