еҗёзғӯеҸҚеә”е’Ңж”ҫзғӯеҸҚеә” зҹҘиҜҶзӮ№йўҳеә“
в‘ еҶ°йӣӘиһҚеҢ– в‘ЎKMnO4еҲҶи§ЈеҲ¶O2 в‘ўй“қдёҺж°§еҢ–й“Ғзҡ„еҸҚеә” в‘Јй’ дёҺж°ҙеҸҚеә” в‘ӨдәҢж°§еҢ–зўідёҺзҒјзғӯжңЁзӮӯеҸҚеә” в‘Ҙзўҳзҡ„еҚҮеҚҺ в‘ҰBaпјҲOHпјү2вҖў8H2Oе’ҢNH4ClеҸҚеә”пјҺ


-
пјҲ1пјү з ”з©¶е°Ҹз»„еҒҡиҜҘе®һйӘҢж—¶зҺҜеўғжё©еәҰпјҲеЎ«вҖңй«ҳдәҺвҖқгҖҒвҖңдҪҺдәҺвҖқжҲ–вҖңзӯүдәҺвҖқпјү22в„ғпјҺ
-
пјҲ2пјү з”ұйўҳе№ІеҸҠеӣҫеҪўеҸҜзҹҘпјҢV1пјҡV2=ж—¶пјҢй…ёзўұжҒ°еҘҪе®Ңе…Ёдёӯе’ҢпјҢжӯӨеҸҚеә”жүҖз”ЁNaOHжә¶ж¶Ізҡ„жө“еәҰеә”дёәmol/L
-
пјҲ3пјү иӢҘйҖҡиҝҮе®һйӘҢжөӢе®ҡеҸҠжңүе…іи®Ўз®—зҹҘжӯӨеҸҚеә”е…ұж”ҫеҮәQ KJзҡ„зғӯйҮҸпјҢиҜ·еҶҷеҮәжӯӨеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸпјҡ
-
пјҲ4пјү иҜ·з®ҖиҰҒиҜҙжҳҺеӣҫ2иЈ…зҪ®зҡ„дёҚи¶ід№ӢеӨ„пјҺ
в‘ иҜҘеҸҚеә”дёәеҸҚеә”пјҲеЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқпјүпјҺ
в‘ЎиҜҘеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮйҡҸж—¶й—ҙзҡ„еҸҳеҢ–еӣҫиұЎеҰӮеӣҫжүҖзӨәпјҢеҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲеЎ«еәҸеҸ·пјүпјҺ
aпјҺt1ж—¶еҲ»иҜҘеҸҚеә”е·Із»ҸеӨ„дәҺеҢ–еӯҰе№іиЎЎзҠ¶жҖҒ
bпјҺt2ж—¶еҲ»cпјҲCO2пјү=cпјҲCOпјү
cпјҺt2ж—¶еҲ»иҜҘеҸҚеә”д»Қ然еӨ„дәҺеҢ–еӯҰе№іиЎЎзҠ¶жҖҒ
dпјҺt2ж—¶еҲ»пјҢж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜеўһеӨ§дәҶCзҡ„зү©иҙЁзҡ„йҮҸпјҺ


дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү

 2NH3вҶ‘+CaCl2+2H2O
B . 2Al+Fe2O3
2NH3вҶ‘+CaCl2+2H2O
B . 2Al+Fe2O3  2Fe+Al2O3
C . Mg+2HCl=MgCl2+H2вҶ‘
D . C+O2
2Fe+Al2O3
C . Mg+2HCl=MgCl2+H2вҶ‘
D . C+O2  CO2
CO2
 CO2 + 2H2O
D . Ba(OH)2В·8H2O + 2NH4Cl = BaCl2 + 2NH3вҶ‘ + 10H2O
CO2 + 2H2O
D . Ba(OH)2В·8H2O + 2NH4Cl = BaCl2 + 2NH3вҶ‘ + 10H2O

в‘ еҶ°йӣӘиһҚеҢ– в‘ЎKMnO4еҲҶи§ЈеҲ¶O2 в‘ўй“қдёҺж°§еҢ–й“Ғзҡ„еҸҚеә” в‘Јй’ дёҺж°ҙеҸҚеә” в‘ӨдәҢж°§еҢ–зўідёҺзҒјзғӯзҡ„жңЁзӮӯеҸҚеә” в‘Ҙзўҳзҡ„еҚҮеҚҺ в‘ҰBa(OH)2В·8H2Oе’ҢNH4Clзҡ„еҸҚеә”.

 2SO3(g)дёәж”ҫзғӯеҸҚеә”пјҢеҲҷSO2зҡ„иғҪйҮҸдёҖе®ҡй«ҳдәҺSO3зҡ„иғҪйҮҸ
B . зәҜй”ҢдёҺзЁҖзЎ«й…ёеҸҚеә”ж—¶пјҢж»ҙе…Ҙе°‘йҮҸзЎ«й…ёй“ңжә¶ж¶ІеҗҺеҸҚеә”йҖҹзҺҮеҠ еҝ«
C . е·ІзҹҘC(зҹіеўЁпјҢs)=C(йҮ‘еҲҡзҹіпјҢs) О”Hпјһ0пјҢеҲҷйҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ
D . иӢҘ1molSO2дёҺ0.5molO2еҸҚеә”з”ҹжҲҗSO3ж”ҫеҮәзҡ„зғӯйҮҸдёә47.8kJпјҢеҲҷиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸеҸҜиЎЁзӨәдёә2SO2(g)+O2(g)
2SO3(g)дёәж”ҫзғӯеҸҚеә”пјҢеҲҷSO2зҡ„иғҪйҮҸдёҖе®ҡй«ҳдәҺSO3зҡ„иғҪйҮҸ
B . зәҜй”ҢдёҺзЁҖзЎ«й…ёеҸҚеә”ж—¶пјҢж»ҙе…Ҙе°‘йҮҸзЎ«й…ёй“ңжә¶ж¶ІеҗҺеҸҚеә”йҖҹзҺҮеҠ еҝ«
C . е·ІзҹҘC(зҹіеўЁпјҢs)=C(йҮ‘еҲҡзҹіпјҢs) О”Hпјһ0пјҢеҲҷйҮ‘еҲҡзҹіжҜ”зҹіеўЁзЁіе®ҡ
D . иӢҘ1molSO2дёҺ0.5molO2еҸҚеә”з”ҹжҲҗSO3ж”ҫеҮәзҡ„зғӯйҮҸдёә47.8kJпјҢеҲҷиҜҘеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸеҸҜиЎЁзӨәдёә2SO2(g)+O2(g)  2SO3(g) О”H=пјҚ95.6 kJвҲҷmolвҲ’1
2SO3(g) О”H=пјҚ95.6 kJвҲҷmolвҲ’1
в‘ ж¶ІжҖҒж°ҙжұҪеҢ– в‘Ўе°ҶиғҶзҹҫеҠ зғӯеҸҳдёәзҷҪиүІзІүжң« в‘ўжө“зЎ«й…ёзЁҖйҮҠ в‘Јж°Ҝй…ёй’ҫеҲҶи§ЈеҲ¶ж°§ж°” в‘Өз”ҹзҹізҒ°и·ҹж°ҙеҸҚеә”з”ҹжҲҗзҶҹзҹізҒ°
 з”Ізғ·е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙж—¶ж”ҫеҮә
з”Ізғ·е®Ңе…ЁзҮғзғ§з”ҹжҲҗж¶ІжҖҒж°ҙж—¶ж”ҫеҮә зғӯйҮҸгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү
зғӯйҮҸгҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜпјҲ пјү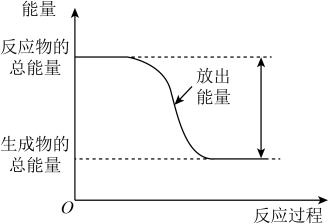
 C . еҸҚеә”з”ҹжҲҗж°”жҖҒж°ҙж—¶ж”ҫеҮәзҡ„зғӯйҮҸеӨ§дәҺ
C . еҸҚеә”з”ҹжҲҗж°”жҖҒж°ҙж—¶ж”ҫеҮәзҡ„зғӯйҮҸеӨ§дәҺ D . еҸҚеә”иҝҮзЁӢдёӯиғҪйҮҸеҸҳеҢ–еҸҜз”ЁеӣҫиЎЁзӨә
D . еҸҚеә”иҝҮзЁӢдёӯиғҪйҮҸеҸҳеҢ–еҸҜз”ЁеӣҫиЎЁзӨә

-
пјҲ1пјү е®һйӘҢж—¶е…Ҳз”Ёй…’зІҫе–·зҒҜеҠ зғӯеӮ¬еҢ–еүӮпјҢ然еҗҺйҖҡе…ҘеҸҚеә”ж°”дҪ“пјҢеҪ“еӮ¬еҢ–еүӮзәўзғӯеҗҺж’ӨзҰ»й…’зІҫе–·зҒҜпјҢеӮ¬еҢ–еүӮе§Ӣз»ҲдҝқжҢҒзәўзғӯпјҢжё©еәҰеҸҜиҫҫеҲ°700в„ғд»ҘдёҠгҖӮдёӢеҲ—еӣҫзӨәдёӯпјҢиғҪеӨҹжӯЈзЎ®иЎЁзӨәиҜҘеҸҚеә”иҝҮзЁӢиғҪйҮҸеҸҳеҢ–зҡ„жҳҜ____(еЎ«еӯ—жҜҚ)гҖӮA .
 B .
B .  C .
C . 
-
пјҲ2пјү й«ҳжё©ж—¶пјҢ
 пјҢ еӣ жӯӨж°Ёж°”дёҺж°§ж°”еҸҚеә”йҡҫд»Ҙз”ҹжҲҗ
пјҢ еӣ жӯӨж°Ёж°”дёҺж°§ж°”еҸҚеә”йҡҫд»Ҙз”ҹжҲҗ гҖӮж №жҚ®дёӢеҲ—1molзү©иҙЁж–ӯй”®ж—¶зҡ„иғҪйҮҸж•°жҚ®и®Ўз®—пјҢеҪ“
гҖӮж №жҚ®дёӢеҲ—1molзү©иҙЁж–ӯй”®ж—¶зҡ„иғҪйҮҸж•°жҚ®и®Ўз®—пјҢеҪ“ е®Ңе…ЁеҲҶи§Јж—¶пјҢеҸҚеә”дјҡ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңж”ҫеҮәвҖқ)kJиғҪйҮҸгҖӮ
е®Ңе…ЁеҲҶи§Јж—¶пјҢеҸҚеә”дјҡ(еЎ«вҖңеҗёж”¶вҖқжҲ–вҖңж”ҫеҮәвҖқ)kJиғҪйҮҸгҖӮ
-
пјҲ3пјү еңЁ2Lзҡ„жҒ’жё©еҜҶй—ӯе®№еҷЁдёӯпјҢеҸ‘з”ҹеҸҚеә”
 пјҢ йҖҡе…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„NOе’Ң
пјҢ йҖҡе…Ҙзӯүзү©иҙЁзҡ„йҮҸзҡ„NOе’Ң ж°”дҪ“пјҢn(NO)йҡҸж—¶й—ҙзҡ„еҸҳеҢ–еҰӮдёӢиЎЁпјҡ
ж°”дҪ“пјҢn(NO)йҡҸж—¶й—ҙзҡ„еҸҳеҢ–еҰӮдёӢиЎЁпјҡt/s
0
1
2
3
4
5
n(NO)/mol
0.020
0.012
0.008
0.005
0.004
0.004
в‘ жҹҗеҗҢеӯҰз”ұж•°жҚ®жҺЁжөӢпјҢеҸҚеә”еңЁз¬¬4sж—¶жҒ°еҘҪеҲ°иҫҫе№іиЎЎзҠ¶жҖҒгҖӮиҜҘжҺЁжөӢ(еЎ«вҖңжӯЈзЎ®вҖқжҲ–вҖңй”ҷиҜҜвҖқ)
в‘ЎеңЁз¬¬5sж—¶пјҢ
 зҡ„иҪ¬еҢ–зҺҮдёәгҖӮ
зҡ„иҪ¬еҢ–зҺҮдёәгҖӮв‘ўе®№еҷЁдёӯж··еҗҲж°”дҪ“еҺӢејәдёҺеҸҚеә”ејҖе§Ӣж—¶зҡ„еҺӢејәжҜ”еҖјдёәгҖӮ
 пјҢ еӣҫ1иЎЁзӨә200в„ғж—¶е®№еҷЁдёӯAгҖҒBгҖҒCзү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙзҡ„еҸҳеҢ–е…ізі»пјҢеӣҫ2иЎЁзӨәдёҚеҗҢжё©еәҰдёӢе№іиЎЎж—¶Cзҡ„дҪ“з§ҜеҲҶж•°йҡҸиө·е§Ӣn(A)пјҡn(B)зҡ„еҸҳеҢ–е…ізі»гҖӮеҲҷдёӢеҲ—з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲ пјү
пјҢ еӣҫ1иЎЁзӨә200в„ғж—¶е®№еҷЁдёӯAгҖҒBгҖҒCзү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙзҡ„еҸҳеҢ–е…ізі»пјҢеӣҫ2иЎЁзӨәдёҚеҗҢжё©еәҰдёӢе№іиЎЎж—¶Cзҡ„дҪ“з§ҜеҲҶж•°йҡҸиө·е§Ӣn(A)пјҡn(B)зҡ„еҸҳеҢ–е…ізі»гҖӮеҲҷдёӢеҲ—з»“и®әжӯЈзЎ®зҡ„жҳҜпјҲ пјү
 пјҢ дё”жӯЈеҸҚеә”еҗёзғӯпјҢa=1
C . иӢҘеңЁеӣҫ1жүҖзӨәзҡ„е№іиЎЎзҠ¶жҖҒдёӢеҶҚеҗ‘дҪ“зі»дёӯе……е…Ҙ0.2mol Bе’Ң0.2mol CпјҢжӯӨж—¶vжӯЈ=vйҖҶ
D . 200в„ғж—¶пјҢеҗ‘2LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ2mol Aе’Ң1mol BпјҢиҫҫеҲ°е№іиЎЎж—¶Aзҡ„дҪ“з§ҜеҲҶж•°е°ҸдәҺ0.5
пјҢ дё”жӯЈеҸҚеә”еҗёзғӯпјҢa=1
C . иӢҘеңЁеӣҫ1жүҖзӨәзҡ„е№іиЎЎзҠ¶жҖҒдёӢеҶҚеҗ‘дҪ“зі»дёӯе……е…Ҙ0.2mol Bе’Ң0.2mol CпјҢжӯӨж—¶vжӯЈ=vйҖҶ
D . 200в„ғж—¶пјҢеҗ‘2LжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯе……е…Ҙ2mol Aе’Ң1mol BпјҢиҫҫеҲ°е№іиЎЎж—¶Aзҡ„дҪ“з§ҜеҲҶж•°е°ҸдәҺ0.5



