反应热和焓变 知识点题库
H2与ICl的反应分①、②两步进行,其能量曲线如下图所示,下列有关说法错误的是( )

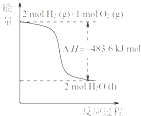 热化学方程式是H2(g)+
热化学方程式是H2(g)+  O2(g)=H2O(g)△H=﹣241.8 kJ/mol
B .
O2(g)=H2O(g)△H=﹣241.8 kJ/mol
B .  对于恒温恒容条件下的反应2NO2(g)⇌N2O4(g),A点为平衡状态
C .
对于恒温恒容条件下的反应2NO2(g)⇌N2O4(g),A点为平衡状态
C .  将A,B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D .
将A,B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D . 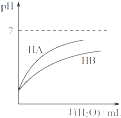 同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
同温度、同浓度的NaA溶液与NaB溶液相比,其pH前者小于后者
 Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
Si(s)+4HCl(g),根据下表列举的化学键的键能数据,判断该反应的反应热(ΔH)为( )
 nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
nQ(g)的平衡体系中,Q的物质的量浓度c(Q)与温度T的关系(曲线上的点表示平衡状态)。下列有关该反应的描述错误的是( )
-
(1) 已知:N2(g)+O2(g)=2NO(g) ΔH=akJ·mol-1
2NO(g)+O2(g)=2NO2(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=c kJ·mol-1
反应8NH3(g)+6NO2(g)=7N2(g)+12H2O(l) ΔH=kJ·mol-1。
-
(2) 水体中过量氨氮(以NH3表示)会导致水体富营养化。
①用次氯酸钠除去氨氮的原理如图1所示。写出该图示的总反应化学方程式:。该反应需控制温度,温度过高时氨氮去除率降低的原因是。
 图1
图1 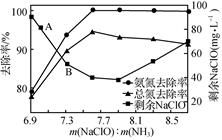 图2
图2图3
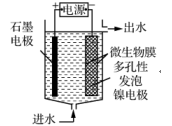
②取一定量的含氨氮废水,改变加入次氯酸钠的用量,反应一段时间后,溶液中氨氮去除率、总氮(溶液中所有可溶性的含氮化合物中氮元素的总量)去除率以及剩余次氯酸钠的含量随m(NaClO)∶m(NH3)的变化情况如图2所示。点B剩余NaClO含量低于点A的原因是。当m(NaClO)∶m(NH3)>7.6时,水体中总氮去除率反而下降,可能的原因是。
-
(3) 电极生物膜电解脱硝是电化学和微生物工艺的组合。某微生物膜能利用电解产生的活性原子将NO3-还原为N2 , 工作原理如图3所示。
①写出该活性原子与NO3-反应的离子方程式:。
②若阳极生成标准状况下2.24 L气体,理论上可除去NO3-的物质的量为mol。
| 化学键 | C—H | C—F | H—F | F—F |
| 键能/(kJ | 414 | 489 | 565 | 155 |
 mol-1
B . +485 kJ
mol-1
B . +485 kJ  mol-1
C . +1940 kJ
mol-1
C . +1940 kJ  mol-1
D . -1940 kJ
mol-1
D . -1940 kJ  mol-1
mol-1
 pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( )
pC(g)的速率和平衡的影响,图像如下,下列判断正确的是( ) 
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ·mol-1
途径Ⅱ:C3H8(g)―→C3H6(g)+H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ·mol-1 (a、b、c、d均为正值)
请回答下列问题:
-
(1) 由于C3H8(g)→C3H6(g)+H2(g)的反应中,反应物具有的总能量(填“大于”、“小于”或“等于”)生成物具有的总能量,那么在化学反应中,反应物就需要(填“放出”或“吸收”)能量才能转化为生成物,因此其反应条件是。
-
(2) 按途径Ⅱ反应,1 mol C3H8完全燃烧时放出的热量为 kJ(用含b、c、d的代数式表示),等量的丙烷通过两种途径完全燃烧时,途径Ⅰ放出的热量(填“大于”、“小于”或“等于”)途径Ⅱ放出的热量。
-
(3) a与b、c、d的数学关系式是。
CO(g)+ 2H2(g)  CH3OH(g) △H
CH3OH(g) △H
-
(1) 已知2CO(g) + O2(g) = 2CO2(g) △H=-566kJ•mol-1;
2H2(g) + O2(g) = 2H2O(l) △H=-572kJ•mol-1;
且CH3OH(g)+
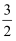 O2(g)
O2(g)  CO2(g)+2H2O(l) △H=-761kJ•mol-1;
CO2(g)+2H2O(l) △H=-761kJ•mol-1;则CO(g)+ 2H2(g)
 CH3OH(g)的△H= 。
CH3OH(g)的△H= 。 -
(2) 为了提高CO和H2制备甲醇生产效率和产量,工业生产中通常采取的措施是。(写出两点)
-
(3) 实验室模拟用CO和H2反应来制甲醇,在250 ℃下,将一定量的CO和H2投入10 L的密闭容器中,各物质的物质的量浓度(mol·L-1)变化如下表所示:
2 min
4 min
6 min
CO
0.07
0.05
0.05
H2
x
0.10
0.10
CH3OH
0.03
0.05
0.05
①250℃时,该反应的平衡常数K=;
②在图1中画出反应开始至第6 min时H2的物质的量的变化曲线,并标出合适的纵坐标。

-
(4) 利用电解甲醇水溶液制备氢气最大的优点就是需要的电压低,装置如图2,写出阳极电极反应方程式,电解的总反应化学方程式。
 来生产燃料甲醇的反应原理:
来生产燃料甲醇的反应原理:  ,某些化学键的键能数据如下表,
,某些化学键的键能数据如下表,  与氢气充分反应的能量变化为( )
与氢气充分反应的能量变化为( ) | 化学键 | | | | | | |
| 键能/ | 348 | 413 | 436 | 358 | 750 | 463 |
 B . 放热
B . 放热  C . 放热
C . 放热  D . 放热
D . 放热 
 CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
CH3OH(g)ΔH=-90.8kJ·mol-1。一定条件下,将1molCO和3molH2通入2L的恒容密闭容器中,5min时测得H2的物质的量为2.4mol。下列说法正确的是( )
 下列气态分子形成独立的气态原子时需要的能量数据如下表:
下列气态分子形成独立的气态原子时需要的能量数据如下表: | 物质 | | | |
| 能量( | a | 498 | 632 |
已知  ∆H=180kJ∙mol-1 , 则a为( )
∆H=180kJ∙mol-1 , 则a为( )
 反应过程的能量变化如图所示。下列说法正确的是( )
反应过程的能量变化如图所示。下列说法正确的是( )
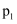 的键能总和大于产物
的键能总和大于产物 的键能总和
B . 产物
的键能总和
B . 产物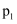 与
与 的分子式相同,但稳定性
的分子式相同,但稳定性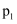 强于
强于 C . 该历程中正反应能垒的最大值为
C . 该历程中正反应能垒的最大值为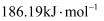 D . 相同条件下,中间产物Z转化为产物的速率:
D . 相同条件下,中间产物Z转化为产物的速率:
选项 | 化学反应方程式 | 已知条件 | 预测 |
A | A(s)=B(g)+C(s) | △H>0 | 它一定是非自发反应 |
B | A(g)+2B(g)=2C(g)+3D(g) | 能自发反应 | △H一定小于0 |
C | M(s)+aN(g)=2Q(g) | △H<0,自发反应 | a可能等于1、2、3 |
D | M(s)+N(g)=2Q(s) | 常温下,自发进行 | △H>0 |
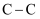
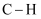
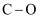
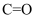
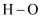
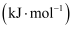


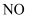
 )
)


