反应热和焓变 知识点题库
CuSO4•5H2O(s)=Cu2+(aq)+SO42﹣(aq)+5H2O(l) 热效应为△H1;将 1mol CuSO4(s)溶于水会使溶液温度升高,其过程表示为:CuSO4(s)=Cu2+(aq)+SO42﹣(aq) 热效应为△H2;CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)  CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
CuSO4(s)+5H2O(l),热效应为△H3 . 则下列判断正确的是( )
 O2(g)+H2(g)△H1
O2(g)+H2(g)△H1H2(g)+Cl2(g)═2HCl(g)△H2
2H2O(g)+2Cl2(g)═4HCl(g)+O2(g)△H3
则△H3与△H1和△H2间的关系正确的是( )
①2CH4(g)+4O2(g)═2CO2(g)+4H2O(l)△H=﹣890.3kJ•mol﹣1
②2H2(g)+O2(g)═2H2O(l)△H=﹣571.6kJ•mol﹣1
③C(s)+O2(g)═CO2(g)△H=﹣393.5Kj•mol﹣1

-
(1) 在深海中存在一种甲烷细菌,它们依靠酶使甲烷气体与O2作用而产生的能量存活,甲烷细菌使1mol甲烷生成CO2气体与液态水,放出的能量(填“>”、“<”或“=”)890.3kJ.
-
(2) 甲烷与CO2可用于合成合成气(主要成分是一氧化碳和氢气):CH4+CO2═2CO+2H2 , 1g CH4完全反应可释放15.46kJ的热量,则:
①图1(所有物质均为气态)能表示该反应过程中能量变化的是(填字母).
②若将物质的量均为1mol的CH4与CO2充入某恒容密闭容器中,体系放出的热量随时间的变化如图2所示,则CH4的转化率为.
-
(3) C(s)与H2(g)不反应,所以C(s)+2H2(g)═CH4(g)的反应热无法直接测量,但通过上述反应可求出C(s)+2H2(g)═CH4(g)的反应热△H=.
-
(4) 目前对于上述三种物质的研究是燃料研究的重点,下列关于上述三种物质的研究方向中可行的是 (填字母).A . 寻找优质催化剂,使CO2与H2O反应生成CH4与O2 , 并放出热量 B . 将固态碳合成为C60 , 以C60作为燃料 C . 寻找优质催化剂,利用太阳能使大气中的CO2与海底开采的CH4合成合成气(CO、H2)
-
(1) 乙二醇气相催化氧化法
以乙二醇、氧气为原料,在催化剂存在的条件下,250℃左右开始缓慢进行,生成乙二醛和副产物乙醇酸[CH2(OH)COOH]的反应方程式:
I.HOCH2CH2OH(g)+O2(g)
 OHC-CHO(g)+2H2O(g) △H1
OHC-CHO(g)+2H2O(g) △H1II.HOCH2CH2OH(g)+O2(g)
 CH2(OH)COOH(g)+H2O(g) △H2
CH2(OH)COOH(g)+H2O(g) △H2已知反应I中相关化学键键能数据如下:
化学键
C-H
C-O
H-O
O=O
C=O
C-C
E/kJ·mol-1
413
343
465
498
728
332
①△H1=kJ/mol,反应I的化学平衡常数表达式为K=。
②欲提高I的平衡产率,可以采取的措施是 (填标号)。
A.升高温度
B.增大压强
C.降低温度
D.减小压强
③提高乙二醛反应选择性的关键因素是。
④保持温度和容积不变,下列描述能说明反应I达到平衡状态的是 (填标号)。
A.v正(O2) =2v逆(H2O)
B.混合气体的压强不再随时间变化而变化
C.混合气体的密度不再发生变化
D.乙二醇与OHC-CHO 的物质的量之比为1: 1
E.混合气体中乙二醛的体积分数不再发生变化
-
(2) 乙醛(CH3CHO)液相硝酸氧化法
11.0g40%的乙醛溶液和40%的硝酸,按一定比例投入氧化反应釜内,在Cu(NO3)2催化下,控制温度在38~40℃时,反应10h,再通过萃取等操作除去乙醛、硝酸等,最后经减压浓缩得4.35g40%乙二醛溶液。
①用稀硝酸氧化乙醛制取乙二醛时,有N2O产生。其化学方程式为。
②利用上面数据,计算乙二醛的产率为。
 2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
 2ClNO(g)获得。
2ClNO(g)获得。
-
(1) 氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
①2NO2(g)+NaCl(s)
 NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1②4NO2(g)+2NaCl(s)
 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2③2NO(g)+Cl2(g)
 2ClNO(g) K3
2ClNO(g) K3则K3=(用K1、K2表示)。
-
(2) 已知几种化学键的键能数据如表所示(亚硝酰氯的结构为Cl-N=O):
化学键
N≡O(NO)
Cl-Cl
Cl-N
N=O
键能/(kJ/mol)
630
243
a
607
则反应2NO(g)+Cl2(g)
 2ClNO(g)的ΔH和a的关系为ΔH=kJ/mol。
2ClNO(g)的ΔH和a的关系为ΔH=kJ/mol。
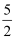 O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法正确的是( )
O2(g)=2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法正确的是( )
-
(1) 已知3H2(g)+N2(g)
 2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:
2NH3(g),某温度下,在容积恒定为2.0L的密闭容器中充入2.0molN2和2.0molH2 , 一段时间后反应达平衡状态,实验数据如下表所示:
t/s
0
50
150
250
350
n(NH3)/mol
0
0.24
0.36
0.40
0.40
0~50s内的平均反应速率v(N2)=。
-
(2) 已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。N
 N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中(填“吸收”或“放出”)的能量为。
N的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1molNH3过程中(填“吸收”或“放出”)的能量为。
-
(3) 为加快反应速率,可以采取的措施是。
a.降低温度 b.增大压强 c.恒容时充入He气 d.恒压时充入He气 e.及时分离NH3
-
(4) CO2的回收与利用是科学家研究的热点课题,可利用CH4与CO2制备“合成气”(CO、H2)。科学家提出制备“合成气”反应历程分两步:
反应①:CH4(g)
 C(ads)+2H2(g)(慢反应)
C(ads)+2H2(g)(慢反应)反应②:C(ads)+CO2(g)
 2CO(g)(快反应)
2CO(g)(快反应)上述反应中C(ads)为吸附性活性炭,反应历程的能量变化如图:

CH4与CO2制备“合成气”的热化学方程式为。能量变化图中:E5+E1E4+E2(填“>”、“<”或“=”)。
-
(1) I.把煤作为燃料可通过下列两种途径:
途径1:C(s) +O2 (g)=CO2(g) ΔH1<0 ①
途径2:先制成水煤气:C(s) +H2O(g) = CO(g)+H2(g) ΔH2>0 ②
再燃烧水煤气:2 CO(g)+O2 (g)=2CO2(g) ΔH3<0 ③
2H2(g)+O2 (g) =2H2O(g) ΔH4<0 ④
请回答下列问题:
途径I放出的热量( 填“大于”“等于”或“小于”) 途径II放出的热量。
-
(2) ΔH1、ΔH2、ΔH3、ΔH4的数学关系式是。
-
(3) II.某氮肥厂含氮废水中的氮元素多以
 和NH3·H2O形式存在,处理过程中
和NH3·H2O形式存在,处理过程中  在微生物的作用下经过两步反应被氧化成
在微生物的作用下经过两步反应被氧化成  ,这两步反应过程中的能量变化如图所示:
,这两步反应过程中的能量变化如图所示: 
1mol
 (aq)全部被氧化成
(aq)全部被氧化成  (aq)的热化学方程式是
(aq)的热化学方程式是 -
(4) III.氮氧化物是造成光化学烟雾和臭氧层损耗的主要气体,已知:
①CO(g)+NO2(g)=NO(g)+CO2(g) ΔH= -a kJ•mol-1(a>0)
②2CO(g)+2NO (g)=N2(g)+2CO2(g) ΔH= -b kJ•mol-1(b>0)
若用标准状况下 3.36L CO还原NO2至N2(CO完全反应)的整个过程中转移电子的物质的量为mol,放出的热量为kJ(用含有a和b的代数式表示)。
-
(5) 用CH4催化还原NOx也可以消除氮氧化物的污染.例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH1= -574kJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH2=?
若1mol CH4还原NO2至N2整个过程中放出的热量为867kJ,则ΔH2=.
①H2(g)+  O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
O2(g)═H2O(l) △H=﹣285.8kJ•mol﹣1
②H2(g)+  O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
O2(g)═H2O(g) △H=﹣241.8kJ•mol﹣1
③C(s)+  O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
O2(g)═CO(g) △H=﹣110.5kJ•mol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJ•mol﹣1
回答下列各问题:
-
(1) 上述反应中属于放热反应的是。
-
(2) H2的燃烧热为;C的燃烧热为。
-
(3) 燃烧10gH2生成液态水,放出的热量为。
-
(4) CO燃烧热的热化学方程式为。
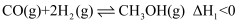 ;其中的原料气常用反应②来制备:
;其中的原料气常用反应②来制备:  。根据题意完成下列各题:
。根据题意完成下列各题:
-
(1) 判断反应①达到平衡状态的标志是(填字母)。
a.
 体积分数保持不变
体积分数保持不变b.
 和
和  浓度相等
浓度相等c.容器中气体的压强不变
d.
 的生成速率与
的生成速率与  的消耗速率相等
的消耗速率相等e.容器中混合气体的密度保持不变
-
(2) 欲提高反应①
 中的转化率,下列措施可行的是(填字母)。
中的转化率,下列措施可行的是(填字母)。 a.向装置中再充入
 b.升高温度
b.升高温度c.改变反应的催化剂 d.向装置中再充入

-
(3) 一定条件下,反应②中
 的平衡转化率与温度的关系如图所示。
的平衡转化率与温度的关系如图所示。 
则
 0(填“<”、“>”或“=”),在
0(填“<”、“>”或“=”),在  时的
时的 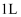 密闭容器中,充入
密闭容器中,充入  和
和  ,发生反应②,经过
,发生反应②,经过 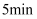 达到平衡,此时
达到平衡,此时  的转化率为
的转化率为 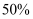 ,则从开始到平衡,
,则从开始到平衡,  的平均反应速率为,
的平均反应速率为,  时该反应的平衡常数为。
时该反应的平衡常数为。 -
(4) 若向此
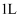 密闭容器中,加入
密闭容器中,加入  、
、  、
、  和
和  ,发生反应②,若温度仍为
,发生反应②,若温度仍为  ,此时v(正)v(逆)(填“<”、“>”或“=”),若改变反应温度,达到新平衡时,
,此时v(正)v(逆)(填“<”、“>”或“=”),若改变反应温度,达到新平衡时, 
 。
。
-
(1) 已知:①N2(g)+O2(g)=2NO(g) ΔH=+180.5kJgmol-1
②C和CO的燃烧热分别为393.5kJ×mol-1和283kJ×mol-1
则2NO(g)+2CO(g)=N2(g)+2CO2(g) ΔH=。
-
(2) 已知充分燃烧乙炔(C2H2)气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则表示乙炔燃烧热的热化学方程式为。
-
(3) 25℃,101kPa时,强酸与强碱的稀溶液反应时,每生成1molH2O(l)会放出57.3kJ的热量,写出表示氢氧化钠溶液和稀硫酸反应的中和热的热化学方程式为:
-
(4) 在两个恒温、恒容的密闭容器中进行下列两个可逆反应:
(甲)2X(g)⇌Y(g)+Z(s)
(乙)A(s)+2B(g)⇌C(g)+D(g)
当下列物理量不再发生变化时,其中能表明(甲)达到化学平衡状态是;能表明(乙)达到化学平衡状态是。
①混合气体的密度
②反应容器中生成物的百分含量
③反应物的消耗速率与生成物的消耗速率之比等于系数之比
④混合气体的压强
⑤混合气体的平均相对分子质量
⑥混合气体的总物质的量
 D . 稀溶液中:HCl(aq)+NH3·H2O(aq)= NH4Cl(aq)+ H2O(l) ΔH = -57.3 kJ·mol-1
D . 稀溶液中:HCl(aq)+NH3·H2O(aq)= NH4Cl(aq)+ H2O(l) ΔH = -57.3 kJ·mol-1
 2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)
2NH3(g)的反应热和化学平衡常数分别为△H和K, 则相同温度时反应4NH3(g)  2N2(g)+6H2(g)反应热和化学平衡常数为( )
2N2(g)+6H2(g)反应热和化学平衡常数为( )
 。请回答下列问题:
。请回答下列问题:
-
(1) 直接用煤作燃料可能带来的环境问题有(填两条即可)。
-
(2) 利用水煤气合成二甲醚的三步反应如下:



则总反应:
 的
的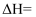
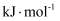
-
(3) 向容积为1L的恒容密闭容器中,充入
 和
和 , 在
, 在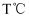 下发生反应,实验测得
下发生反应,实验测得 的物质的量(n)随时间变化的曲线如图1所示。
的物质的量(n)随时间变化的曲线如图1所示。
①
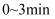 内,反应速率
内,反应速率
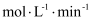 。达到平衡时,压强为
。达到平衡时,压强为 ,
,  为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数),则该温度下的平衡常数
为用平衡分压代替平衡浓度表示的平衡常数(分压=总压×物质的量分数),则该温度下的平衡常数 为
为 。
。②下列说法能判断该反应达到平衡状态的是(填标号)。
A.单位时间内断裂
 键的同时断裂
键的同时断裂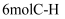 键
键B.

C.

D.混合气体的密度不再变化
-
(4) 恒压条件下,
 的平衡转化率与起始投料比
的平衡转化率与起始投料比 、温度的变化关系如图2所示,则三条曲线对应温度最高的是。测得B点
、温度的变化关系如图2所示,则三条曲线对应温度最高的是。测得B点 的转化率为30%,则
的转化率为30%,则 。
。

 和1mol
和1mol 反应生成2mol
反应生成2mol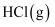 放出ckJ的热量
B . 断开1mol
放出ckJ的热量
B . 断开1mol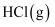 中的
中的 键需要吸收bkJ能量
C . 反应
键需要吸收bkJ能量
C . 反应 , 反应物的总能量小于生成物的总能量
D . 2mol
, 反应物的总能量小于生成物的总能量
D . 2mol 分解成1mol
分解成1mol 和1mol
和1mol 需要吸收ckJ热量
需要吸收ckJ热量

-
(1) I.工业上主要采用氨催化氧化法生产NO:
主反应: 4NH3(g)+5O2(g)
 4NO(g)+6H2O(g ) △H1
4NO(g)+6H2O(g ) △H1副反应: 4NH3(g)+3O2(g)
 2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1
2N2(g)+6H2O(g) △H2=- 1265kJ·mol-1王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气还原合成氨。“N2+ 2*H=中间体”是氮气还原合成氨的决速步,“中间体”为(写化学式)。

-
(2) 已知N2(g)+O2(g)= 2NO(g) △H =+180kJ·mol-1 , 则△H1= kJ·mol -1。
-
(3) 制备NO时,在某种氨的初始含量下,温度升高一段时间后,体系中
 减小,可能的原因是。
减小,可能的原因是。
-
(4) II.已知工业上常利用NO和Cl2反应来制备有机合成中的重要试剂亚硝酰氯(NOCl),化学方程式为2NO(g)+Cl2(g)
 2NOCl(g) △H <0。
2NOCl(g) △H <0。保持恒温恒容条件,将物质的量之和为3mol的NO和Cl2以不同的氮氯比
 进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
进行反应,平衡时某反应物的转化率和氮氯比及不同温度的关系如图所示:
①图中T1、T2的关系为T1T2(填“<”或“=”)
②体系的初始压强为P0 , 则A点的平衡常数Kp= ; (以分压表示,分压=总压×物质的量分数)
-
(5) III. NOx是空气污染物之一,用焦炭还原NO2的反应为: 2NO2(g)+2C(s)
 N2(g)+2CO2(g) △H >0. T℃时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2 , 经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
N2(g)+2CO2(g) △H >0. T℃时,向容积不等的恒容密闭容器中分别加入足量活性炭和1mol NO2 , 经t min,测得各容器中NO2的转化率与容器容积的关系如图所示。
①提高NO2平衡转化率可采取的措施是 (答出两种即可)。
②a点对应的容器,t min内v(NO2)=(用含字母的代数式表示)。
③a、b、c三点中,已达平衡状态的有。



