铁盐和亚铁盐的相互转变 知识点题库
-
(1) 工业上由软锰矿(主要成分为MnO2)生产高锰酸钾分为两个步骤:
①步骤一将软锰矿与过量的固体KOH和空气在高温下反应,生成锰酸钾(K2MnO4), 该反应的化学方程式是。
②步骤二以石墨为阳极,铁为阴极,电解锰酸钾(K2MnO4)溶液,在 (填“阴极区”或“阳极区”)得到高锰酸钾。阴极反应的化学方程式是。
-
(2) 某研究小组用工业生产高锰酸钾产生的废渣——锰泥(含K2MnO4、MnO2及Pb、Ca等元素)和轧钢废酸液制取工业级碳酸锰(MnCO3),其流程如下:
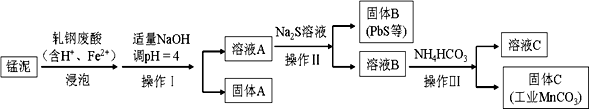
①轧钢废酸中Fe2+的作用是。
②操作I、操作Ⅱ、操作Ⅲ的名称是,
用到的玻璃仪器有。
③溶液C中除含有Ca2+、Mn2+、H+外,还含有的阳离子是。


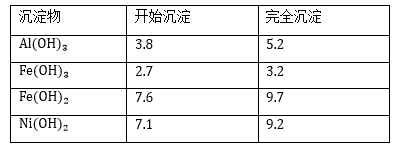
几种难溶碱开始沉淀和完全沉淀的pH:
回答下列问题:
-
(1) 溶液①中含金属元素的离子是;
-
(2) 用离子方程式表示加入双氧水的目的;双氧水可以用下列物质替代的是
A.氧气
 漂白液
漂白液  氯气
氯气  硝酸;
硝酸; -
(3) 操作b调节溶液pH范围为;
-
(4) 操作a和c需要共同的玻璃仪器是;上述流程中,防止浓缩结晶过程中,Ni2+水解的措施是。
-
(1) 把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为。
-
(2) 把Na2CO3和NaHCO3的混合物29.6g加热到质量不再变化时,得残留固体26.5g;则原混合物中Na2CO3的物质的量为:。

 +Fe2+═FeCO3↓+CO2↑+H2O
C . 可用稀硫酸和K3[Fe(CN)6]溶液检验铁红中是否含有FeCO3
D . “冷却结晶”后的操作是过滤,“锻烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
+Fe2+═FeCO3↓+CO2↑+H2O
C . 可用稀硫酸和K3[Fe(CN)6]溶液检验铁红中是否含有FeCO3
D . “冷却结晶”后的操作是过滤,“锻烧”操作的主要仪器有酒精灯、蒸发皿、玻璃棒
| 选项 | 实验 | 现象 | 结论 |
| A | 某无色溶液, 加入足量的稀盐酸 | 生成无色无味的能使澄 清石灰水变浑浊的气体 | 说明原溶液中一定含有 CO |
| B | 将0.1mol/LMgSO4 溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成后变为浅蓝色沉淀 | Cu(OH)2的浓度积比 Mg(OH)2的小 |
| C | 向AgNO3溶液中滴加过量氨水 | 溶液澄清 | Ag+与NH3·H2O能大量共存 |
| D | 向稀硝酸中加入过量Fe粉,反应完全再向溶液中滴加 KSCN溶液 | 溶液变为血红色 | Fe与硝酸反应得到Fe3+ |
 氧化
氧化  时发现异常现象,并对其进行深入探究。
时发现异常现象,并对其进行深入探究。
-
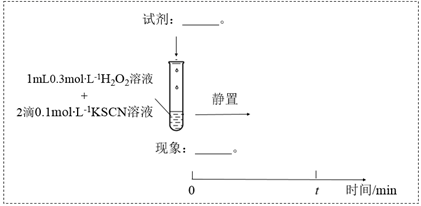
(1) 实验I:
装置与操作
现象
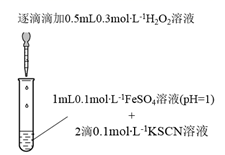
溶液立即变红,继续滴加
 溶液,红色变浅并逐渐褪去
溶液,红色变浅并逐渐褪去实验I中溶液变红是因为
 与
与 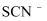 发生了反应,其离子方程式是。
发生了反应,其离子方程式是。 -
(2) 探究实验I中红色褪去的原因:取反应后溶液,(填实验操作和现象),证明溶液中有
 ,而几乎无
,而几乎无 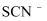 。
。
-
(3) 研究发现,酸性溶液中
 能氧化
能氧化 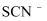 ,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测
,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测  能加快
能加快  与
与 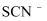 的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III: 。
的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III: 。 实验II:

实验III:
-
(4) 查阅资料:
 加快
加快  与
与 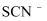 反应的主要机理有
反应的主要机理有 i.
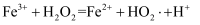
ii.

iii.
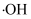 (羟基自由基)具有强氧化性,能直接氧化
(羟基自由基)具有强氧化性,能直接氧化 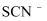
为探究
 对
对  与
与 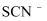 反应速率的影响,设计实验如下:
反应速率的影响,设计实验如下:实验IV:
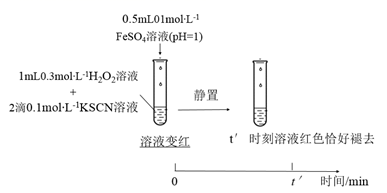
①t′<t,对比实验IV和II可得出结论:在本实验条件下,。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:。
③实验I~IV中均有
 生成,小组同学推测可能是
生成,小组同学推测可能是  与溶液中其他微粒相互作用生成的,这些微粒有。
与溶液中其他微粒相互作用生成的,这些微粒有。
| 选项 | 实验 | 现象 | 结论 |
| A | 向2支盛有5 mL不同浓度NaHSO3溶液的试管中,同时加入2 mL 5% H2O2溶液 | 观察并比较产生气泡的快慢 | 浓度大的反应速率快 |
| B | 取 Al 和Fe2O3 完全反应后固体,溶于足量稀硫酸,滴加 KSCN 溶液 | 溶液不变红 | 反应后固体中可能含有 Fe2O3 |
| C | 将湿润的淀粉-KI 试纸放入含有红棕色气体的集气瓶中 | 试纸变蓝 | 该气体为 NO2 ,具有氧化性 |
| D | 将少量 Fe(NO3)2 加水溶解后,滴加稀硫酸酸化,再滴加 KSCN 溶液 | 溶液呈血红色 | Fe(NO3)2 已变质 |
 而呈红色,铁在自然界中均以化合态的形式存在
B . 钢为铁碳合金,是目前用量最大、用途最广的合金,其硬度比纯铁大
C . 实验室保存亚铁盐溶液时,为了防止亚铁盐被氧化为铁盐,常在试剂瓶中加入少量铁粉
D . 为避免铁在高温条件下与水蒸气反应产生
而呈红色,铁在自然界中均以化合态的形式存在
B . 钢为铁碳合金,是目前用量最大、用途最广的合金,其硬度比纯铁大
C . 实验室保存亚铁盐溶液时,为了防止亚铁盐被氧化为铁盐,常在试剂瓶中加入少量铁粉
D . 为避免铁在高温条件下与水蒸气反应产生 , 钢铁厂中的模具需要充分干燥
, 钢铁厂中的模具需要充分干燥
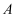 、
、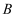 、
、 、
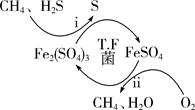
、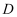 均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题:
均为中学化学中常见的单质或化合物,它们之间的关系如图所示(部分产物略去)。请回答下列问题: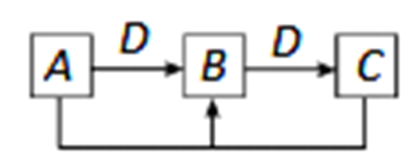
-
(1) 若
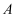 为常见的非金属单质,常温下为固体,
为常见的非金属单质,常温下为固体,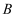 、
、 、
、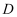 均为气体。
均为气体。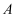 与
与 的反应需要在高温下进行,则二者反应的化学方程式为。
的反应需要在高温下进行,则二者反应的化学方程式为。
-
(2) 若
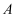 、
、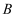 、
、 的溶液均显碱性,
的溶液均显碱性, 常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则
常用于培制糕点的发酵粉的主要成分之一,也可以作为抗酸药剂,则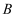 的俗名为,
的俗名为,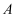 与
与 反应生成
反应生成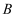 的离子方程式为。
的离子方程式为。
-
(3) 若
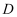 为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。
为用量最大、用途最广泛的金属单质。它的一种氧化物为红棕色固体,可用作颜料。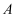 是一种黄绿色气体,则
是一种黄绿色气体,则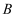 的化学式为,
的化学式为,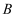 与Cu反应的离子方程式为,
与Cu反应的离子方程式为,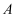 与
与 反应生成B的化学反应方程式为。
反应生成B的化学反应方程式为。
 FeCl3
B . Fe
FeCl3
B . Fe FeSO4
C . Fe
FeSO4
C . Fe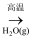 Fe3O4
D . Fe
Fe3O4
D . Fe FeCl2
FeCl2




