铁盐和亚铁盐的相互转变 知识点
铁盐和亚铁盐的相互转变 知识点题库
-
(1) 若铁粉有剩余,则容器中不可能有的离子是,铜单质(填“一定”或“可能”)存在.
-
(2) 若CuCl2有剩余,则容器中还可能有的离子为,铜单质(填“一定”或“可能”)存在.
-
(3) 若FeCl3和CuCl2都有剩余,则容器中不可能有的单质是,Fe2+(填“一定”或“可能”)存在.
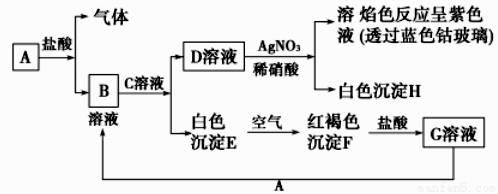
试回答:
-
(1) 写出B的化学式,D的化学式。
-
(2) 写出由E转变成F的化学方程式。
-
(3) 写出下列离子方程式:
D溶液与AgNO3溶液反应;向G溶液中加入A。
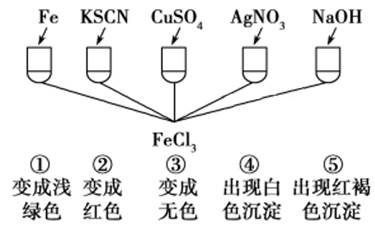
①向Fe2(SO4)3和CuSO4的混合液中加入过量铁粉,充分反应,有红色固体析出,过滤。
②取①中滤液,向其中滴加KSCN溶液,观察现象。
判断下列说法正确的是( )
-
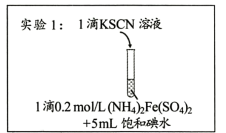
(1) I.初步探究
实验2:用煮沸冷却后的蒸馏水重新配制两种饱和溶液进行实验,实验记录如下表。
编号
饱 和
(NH4)2Fe(SO4)2溶液
饱和碘水
石蜡油
操作
KSCN溶液
现象
2-1
1滴
5mL
1mL
不加热
1滴
无明显现象
2-2
1滴
5mL
1mL
加热一段时间后冷却
1滴
无明显现象
研究小组同学根据所查阅资料写出的Fe3+与I-反应的离子方程式为。
-
(2) 实验2中,加入石蜡油的目的是。
-
(3) 小组同学做出推断:反应速率不是导致实验1中溶液未变红的主要原因,他们的理由是。
-
(4) II.查阅资料,继续探究
(资料)AgSCN为不溶于水的白色固体。

试管a的实验现象说明滤液l中含有。
-
(5) 试管b中,加入KSCN溶液后所产生实验现象的原因是 。
-
(6) 甲同学对实验3提出了质疑,认为其实验现象并不能证明I2氧化了Fe2+。他提出如下假设:i.可能是AgNO3氧化了Fe2+;ii.可能是空气中的O2氧化了Fe2+。 他设计、实施了实验4,实验记录如下表。
编号
实验操作
实验现象
4
在试管中加入1滴0.2mol/L(NH4)2Fe(SO4)2溶液,5mL蒸馏水,1滴试剂a,一段时间后加入1滴KSCN溶液
溶液不变红
①试剂a是 。
②依据实验4,甲同学做出判断:
-
(7) 根据实验1~4所得结论是。
 变化的曲线如图所示。
变化的曲线如图所示。 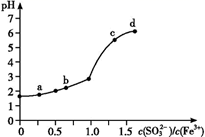
实验发现:
ⅰ.a 点溶液澄清透明,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ⅱ.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出;取其上层清液滴加NaOH溶液后无明显现象,滴加 KSCN 溶液显红色。
下列分析合理的是( )
 发生双水解反应
C . b点较a点溶液pH升高的主要原因:2Fe3++
发生双水解反应
C . b点较a点溶液pH升高的主要原因:2Fe3++  +H2O = 2Fe2++
+H2O = 2Fe2++ 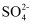 +2H+
D . 向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+
+2H+
D . 向d点上层清液中滴加 NaOH溶液无明显现象,证明溶液中无Fe3+
几种金属离子的氢氧化物沉淀pH如表:
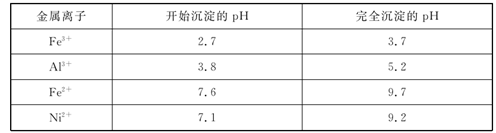
请回答下列问题:
-
(1) “碱浸”过程中,为提高浸出率,可采取的措施是(写一种即可)。
-
(2) “转化”过程中加入H2O2的目的是(用离子方程式表示),经实验测定该过程温度高于40℃,转化率急速降低的原因可能是。
-
(3) 调节pH=a,其中a的取值范围是。
-
(4) 写出“灼烧”NiCO3和NH4F的混合物时的化学反应方程式:,为避免污染环境,选择下列装置吸收尾气,最宜选择(填选项)。
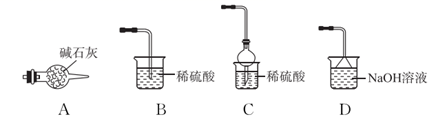
-
(5) 从溶液中获得NiSO4·7H2O的操作A是。
-
(6) 准确称取ω g翠矾晶体产品于锥形瓶中,加入足量的蒸馏水溶解配成250 mL溶液,取20.00 mL所配溶液于锥形瓶中,用c mol·L-1的标准溶液EDTA(Na2H2Y)滴定至终点(发生反应Ni2++H2Y2-=NiY2-+2H+),三次实验消耗标准液的体积分别为20.02 mL、19.98 mL、19.50 mL,则翠矾的纯度为%(只列计算式,不考虑杂质反应)。
-
(1) Ⅰ.化合物A由三种常见元素组成,可以发生如下转化。
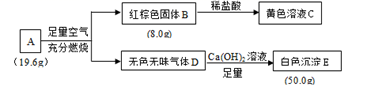
请回答:
化合物A所含的元素有。
-
(2) 写出化合物A在足量空气中充分燃烧的化学方程式。
-
(3) 气体D可与环氧乙烷(
 )通过加聚反应生成全降解塑料,已知过氧键(−O−O−)不稳定,写出反应的化学方程式。
)通过加聚反应生成全降解塑料,已知过氧键(−O−O−)不稳定,写出反应的化学方程式。
-
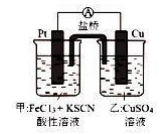
(4) Ⅱ.某学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究,装置如下图。向A中通入氯气至过量,观察到A中溶液先变红后变为黄色。请回答:
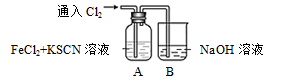
B中反应的离子方程式为。
-
(5) 设计实验方案证明溶液变黄的原因是SCN-与氯气发生了反应。
| 选项 | 实验 | 现象 | 结论 |
| A | 浓硫酸滴入蔗糖中,产生的气体导入澄清石灰水 | 蔗糖变黑、体积膨胀,澄清石灰水变浑浊 | 浓硫酸具有脱水性和强氧化性 |
| B | 铜粉加入稀硫酸中,加热;再加入少量硝酸钾固体 | 加热时无明显现象,加入硝酸钾后溶液变蓝 | 硝酸钾起催化作用 |
| C | 过量铁粉加入稀硝酸中,充分反应后,滴加KSCN溶液 | 有无色气泡产生, 溶液呈血红色 | 稀硝酸能将Fe氧化成Fe3+ |
| D | 将Na粒投入MgCl2溶液 | 析出银白色固体 | 固体为Mg |
 溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。
溶液变黄,一般认为是二价铁被氧化为三价铁的缘故。某研究小组对转化过程进行研究。
-
(1) 甲同学认为在酸性条件下
 易被氧化:
易被氧化: 。其依据是
。其依据是 增大,平衡向移动,
增大,平衡向移动, 增大。
增大。
-
(2) 乙同学依据如下反应,推测在酸性条件下
 不易被氧化: (将反应补充完整)。
不易被氧化: (将反应补充完整)。
 1
1

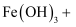

-
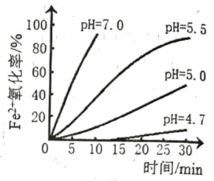
(3) 研究小组测定了常温下不同pH对
 被
被 氧化的氧化率随时间变化的关系,结果如图。结合图像分析可知,增大溶液pH,
氧化的氧化率随时间变化的关系,结果如图。结合图像分析可知,增大溶液pH, 被氧化速率(填“增大”“减小”或“无影响”)。pH越小
被氧化速率(填“增大”“减小”或“无影响”)。pH越小 氧化率越(填“大”或“小”)。
氧化率越(填“大”或“小”)。
-
(4) 室温下,在
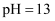 的环境中,
的环境中, 的氧化变质可以理解为:
的氧化变质可以理解为:
第一步:
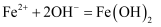
第二步:(用化学方程式回答)
当氧化达到平衡时,

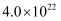 (填“>”“<”或“=”)。(已知的
(填“>”“<”或“=”)。(已知的 ,
,  )
) -
(5) 通过以上研究可知,新配制的
 溶液中常加入适量的铁粉和。
溶液中常加入适量的铁粉和。
电子工业常用30%FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板。
-
(1) 写出FeCl3溶液与金属铜发生反应的离子方程。
-
(2) 某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列步骤:
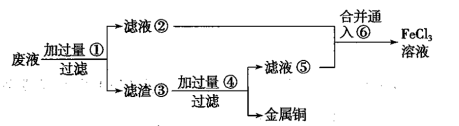
请写出上述过程中滤渣③中所含成分的化学式,物质⑥的化学式。
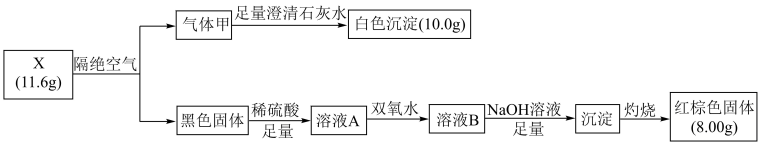
回答下列问题:
-
(1) 气体甲的结构式,X的化学式是。
-
(2) 写出溶液A中加一定量的双氧水后发生反应的离子方程式是。
-
(3) 验证溶液B中可能含有的金属阳离子
 , 下列检验试剂选用正确的是____。
A . 用氯水、KSCN溶液检验是否有
, 下列检验试剂选用正确的是____。
A . 用氯水、KSCN溶液检验是否有 B . 用酸性
B . 用酸性 溶液检验是否有
溶液检验是否有 C . 用
C . 用 溶液检验是否有
溶液检验是否有



