铁盐和亚铁盐的相互转变 知识点题库
将17.6克Fe2O3和Cu的混合物溶解于足量的稀盐酸中,再加铁粉9.8克,待铁粉溶解后,溶液中无Fe3+ , 此过程共产生2.24升H2(标况),则下列判断正确的是( )
A . 混合物中Cu全部被氧化为Cu2+以后,Cu2+又全部被还原
B . 混合物中Cu全部被氧化为Cu2+以后,Cu2+又部分被还原
C . 混合物中Cu部分被氧化为Cu2+以后,Cu2+又全部被还原
D . 混合物中Cu部分被氧化为Cu2+以后,Cu2+又部分被还原
要证明某溶液中不含Fe3+而可能含有Fe2+ . 进行如下实验操作时最佳顺序为( )
①加入适量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液.
A . ①③
B . ③②
C . ③①
D . ①②③
用FeCl3溶液腐蚀印刷电路板上的铜,所得的溶液中加入铁粉.对加入铁粉充分反应后的溶液分析合理的是( )
A . 若无固体剩余,则溶液中一定有Fe3+
B . 若有固体存在,则溶液中一定有Fe2+
C . 若溶液中有Cu2+ , 则一定没有固体析出
D . 若溶液中有Fe2+ , 则一定有Cu析出
下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN﹣;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH﹣ .
A . ①②③
B . ②④⑤
C . ①③⑥
D . ①②⑤
将下列物质溶于稀盐酸后,滴加硫氰化钾(KSCN)溶液没有颜色变化,再加入氯水即呈红色的是( )
A . Fe
B . Fe2O3
C . FeCl3
D . Fe(OH)3
向稀H2SO4中加入铜粉不反应,若再加入某种盐,则铜粉可逐渐溶解,符合此条件的盐是( )
①NaNO3②KCl③ZnSO4④Fe2(SO4)3 .
A . ①③
B . ②③
C . ①③④
D . ①④
向含有FeBr2、FeI2的溶液中通入一定量的氯气后,再向溶液中滴加KSCN溶液,溶液变为红色,则下列叙述不正确的是( )
A . 通入氯气之后原溶液中的Fe2+全部被氧化
B . 通入氯气后的溶液中一定不存在I﹣
C . 原溶液中的Br﹣可能被氧化
D . 若取少量所得溶液,再加入CCl4溶液充分振荡,静置、分液,下层溶液可能呈紫红色
为了防止FeSO4被氧化而变质,实验室在配制FeSO4溶液时,常在溶液中加入少量的( )
A . 铜粉
B . 铁粉
C . 锌粉
D . Fe2(SO4)
下列解释事实的方程式错误的是( )
A . 用湿润的淀粉—KI试纸检验Cl2: Cl2+2I-= 2 Cl-+I2
B . 工业固氮:N2+3H2 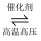 2NH3
C . 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D . 铝热法焊接铁轨:2Fe+Al2O3
2NH3
C . 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D . 铝热法焊接铁轨:2Fe+Al2O3  2Al+Fe2O3
2Al+Fe2O3
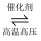 2NH3
C . 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D . 铝热法焊接铁轨:2Fe+Al2O3
2NH3
C . 用FeCl3溶液腐蚀铜质线路板:2Fe3++Cu=2Fe2++Cu2+
D . 铝热法焊接铁轨:2Fe+Al2O3  2Al+Fe2O3
2Al+Fe2O3
下列物质不能通过化合反应得到的是( )
A . Al(OH)3
B . Fe (OH)3
C . Fe3O4
D . FeS
下列实验中,不能观察到明显变化的是( )
A . 把一段打磨过的镁带放入少量冷水中
B . 把Cl2通入FeCl2溶液中
C . 把绿豆大的钾投入水中
D . 把溴水滴加到KI淀粉溶液中
将Cu片放入0.1mol·L−1 FeCl3溶液中,反应一段时间后取出Cu片,溶液中c(Fe3+)∶c(Fe2+)=2∶3,则Fe3+与Cu2+的物质的量之比为( )
A . 3∶2
B . 3∶5
C . 3∶4
D . 4∶3
中科院化学所研制的晶体材料——纳米四氧化三铁,在核磁共振造影及医药上有广泛用途其生产过程的部分流程如下图所示( )
FeCl3·6H2O ![]() FeOOH
FeOOH ![]() 纳米四氧化三铁
纳米四氧化三铁
下列有关叙述不合理的是
A . 纳米四氧化三铁可分散在水中,它与FeCl3溶液的分散质直径相当
B . 纳米四氧化三铁具有磁性,可作为药物载体用于治疗疾病
C . 在反应①中环丙胺的作用可能是促进氯化铁水解
D . 反应②的化学方程式是6FeOOH+CO=2Fe3O4+3H2O十CO2
要除去FeCl2溶液中的少量氯化铁,可行的办法是( )
A . 滴入KSCN溶液
B . 通入氯气
C . 加入铜粉
D . 加入铁粉
固体粉末X中可能含有Cu、FeO、Fe2O3、NaHCO3、Na2CO3、Na2S2O3、NaAlO2中的若干种。某化学兴趣小组为确定该固体粉末的成分,现取X进行连续实验,实验过程及现象如下:

下列说法正确的是( )
A . 气体乙和气体丙都为纯净物
B . 溶液甲中一定含有AlO  ,可能含有
,可能含有  C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
 ,可能含有
,可能含有  C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
C . 溶液丁中的阳离子一定只含H+、Fe2+
D . 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2 , 可能含有NaHCO3、Na2CO3
某氯化铜晶体(CuCl2•2H2O)中含有少量氯化亚铁杂质,某同学设计如下工艺流程制备纯净的CuCl2•2H2O。回答下列问题:

已知Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH如表所示。
| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
-
(1) 试剂X为氧化剂,其最佳试剂是 (填字母),写出用该试剂“氧化”时反应的离子方程式:。
A.NaClO B.H2O2 C.KMnO4
-
(2) “调节pH”的目的是,pH的范围为,选择的试剂Y为(填字母)。
A.CuO B.CuSO4 C.Fe
-
(3) “系列操作”包括蒸发浓缩、、、洗涤、干燥。
在实验中手不慎被玻璃划破,可用FeCl3溶液应急止血,主要原因可能是( )
A . FeCl3溶液能与血液发生化学反应
B . FeCl3溶液能产生Fe(OH)3沉淀堵住伤口
C . FeCl3溶液能使血液聚集沉降
D . FeCl3溶液有杀菌消毒作用
-
(1) 向Fe(OH)3胶体中逐滴加入氢碘酸。
现象:
离子方程式:
-
(2) 将Cl2通入NaOH溶液,充分反应后测得溶液中ClO-与ClO
 个数比为3:1,则被氧化与被还原的氯元素质量比为;离子方程式为。
个数比为3:1,则被氧化与被还原的氯元素质量比为;离子方程式为。
-
(3) H2与Cl2混合点燃,充分反应后,将气体通入含有40gNaOH的溶液中恰好完全反应,则混合气体中Cl2质量为。
-
(4) 向FeBr2溶液中通入一定量的Cl2 , 充分反应后,测得游离态的溴元素和化合态的溴元素质量比为1:1,写出反应的离子方程式。
碳酸亚铁在干燥空气中为白色固体,可用于制铁盐、兽药、补血剂等。利用废铁屑(含少量碳、氧化铝和氧化铁杂质)为原料制取碳酸亚铁,并探究碳酸亚铁的部分性质。回答下列问题:
-
(1) Ⅰ.制碳酸亚铁,工艺流程如图:

常温下几种金属阳离子开始沉淀与完全沉淀时的pH如表:
Fe2+
Fe3+
Al3+
开始沉淀
7.5
2.7
3.8
完全沉淀
9.5
3.7
4.7
酸浸时,所发生氧化还原反应的离子方程式为。
-
(2) 加入氨水调控pH的范围是,“固体”的成分是。
-
(3) 在工业生产中加入的NH4HCO3 , 需过量,下列分析不正确的是(填标号)。
a.使Fe2+充分转化为碳酸亚铁
b.碳酸氢铵受热分解
c.促进Fe2+、CO
 的水解
的水解 -
(4) Ⅱ.探究碳酸亚铁的性质

实验:
由上面实验可以得出碳酸亚铁的相关性质是,写出碳酸亚铁变成红褐色固体所发生反应的化学方程式。
-
(5) 已知:100.8≈6.3,25℃时,Ksp(FeCO3)=3.0×10-11、Ksp[Fe(OH)2]=1.6×10-14。现将碳酸亚铁加入0.1mol·L-1Na2CO3(pH=11.6)溶液中,经计算可知(填“有”或“无”)Fe(OH)2生成。
在指定条件下,下列选项所示物质间转化能实现的是( )
A .  B .
B . 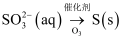 C . 稀
C . 稀 D .
D . 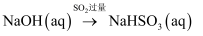
 B .
B . 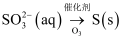 C . 稀
C . 稀 D .
D . 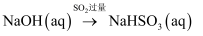
最近更新



