微粒半径大小的比较 知识点题库
下列关系不正确的是( )
A . 离子半径:Clˉ> F ˉ> Na+ > Al3+
B . 熔点:石英>食盐>冰>干冰
C . 结合氢离子的能力:SO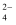 > SO
> SO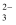 > CO
> CO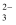 D . 热稳定性: HF > HCl > H2S > PH3
D . 热稳定性: HF > HCl > H2S > PH3
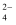 > SO
> SO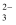 > CO
> CO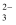 D . 热稳定性: HF > HCl > H2S > PH3
D . 热稳定性: HF > HCl > H2S > PH3
下列离子中半径最大的是( )
A . Na+
B . Mg2+
C . O2-
D . F-
下列化合物中阴离子半径和阳离子半径之比最大的是( )
A . LiI
B . NaBr
C . KCl
D . CsF
短同期主族元家X、Y、Z、W、Q的原子序数依次增大,原子核外最外层电子数是次外层的2倍,Y的氟化物YF3分子中各原子均达到8电子稳定结构,Z、W是常见金属,乙是同周期中原子半径最大的元素,W的简单离子是同周期中离子半径最小的,X和Z原子序数之和与Q的原子序数相等。下列说法正确的是( )
A . 气态氢化物的稳定性:X>Y>Q
B . X与Q形成的化合物和Z与Q形成的化合物的化学键类型相同
C . Z、W、Q三种元素最高价氧化物对应的水化物之间两两均可反应生成盐和水
D . 相同质量的Z和W单质分别与足量稀盐酸反应时,乙的单质制得的氢气多
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是( )
A . 第一电离能:④>③>②>①
B . 原子半径:①>②>④>③
C . 电负性:④>③>②>①
D . 最高正化合价:④>①>③=②
【选修三:物质结构与性质】
近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为Fe−Sm−As−F−O组成的化合物。回答下列问题:
-
(1) 元素As与N同族。预测As的氢化物分子的立体结构为,其沸点比NH3的(填“高”或“低”),其判断理由是。
-
(2) Fe成为阳离子时首先失去轨道电子,Sm的价层电子排布式为4f66s2 , Sm3+的价层电子排布式为。
-
(3) 比较离子半径:F−O2−(填“大于”等于”或“小于”)。
-
(4) 一种四方结构的超导化合物的晶胞结构如图1所示,晶胞中Sm和As原子的投影位置如图2所示。
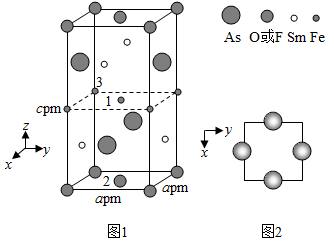
图中F−和O2−共同占据晶胞的上下底面位置,若两者的比例依次用x和1−x代表,则该化合物的化学式表示为,通过测定密度ρ和晶胞参数,可以计算该物质的x值,完成它们关系表达式:ρ=g·cm−3。
以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图1中原子1的坐标为(
 ,
,  ,
,  ),则原子2和3的坐标分别为、。
),则原子2和3的坐标分别为、。
下列结论正确的是( )
①微粒半径:r(K+)>r(Al3+)>r(S2-)>r(Cl-)
②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③还原性:I->Br->Cl->Fe2+
④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>H3BO3
⑥非金属性:O>N>P>Si
⑦金属性:Be<Mg<Ca<K
A . ①②
B . ①③
C . ②④⑤⑥⑦
D . ①③⑤
被誉为“矿石熊猫”的香花石,由我国地质学家首次发现,它由前20号元素中的6种组成,分别为X、Y、Z、W、R、T。其中Ⅹ、Y、Z为金属元素,Z的最外层电子数与次外层电子数相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是( )
A . 原子半径:Y>Z>R>T
B . 气态氢化物的稳定性:W<R<T
C . 最高价氧化物对应的水化物的碱性:X>Z
D . XR2、WR2两种化合物中R的化合价相同
A、B、C、D、E、F、G 为短周期主族元素,其原子半径与最外层电子数的关系如图,下列说法正确的是( )

A . 根据元素B 在元素周期表中的位置推测,其最高价氧化物对应的水化物可能具有两性
B . 元素D在自然界中主要以游离态存在,其单质可用作半导体材料
C . 元素A的离子半径大于元素G的离子半径
D . 元素F 的气态氢化物比元素G的气态氢化物更稳定
下列粒子半径大小的比较正确的是( )
A . 原子半径:  B . 原子半径:
B . 原子半径:  C . 离子半径:
C . 离子半径: 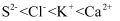 D . 第三周期元素简单离子的半径从左到右逐渐减小
D . 第三周期元素简单离子的半径从左到右逐渐减小
 B . 原子半径:
B . 原子半径:  C . 离子半径:
C . 离子半径: 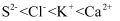 D . 第三周期元素简单离子的半径从左到右逐渐减小
D . 第三周期元素简单离子的半径从左到右逐渐减小
根据元素周期律和物质结构的有关知识,以下有关排序正确的是( )
A . 离子半径:Ca2+>Cl->S2
B . 电负性:O>S>Mg
C . 第一电离能:O>N>C
D . 热稳定性:H2S>H2O>CH4
W、X、Y、Z为原子序数依次增大的四种短周期元素。W与X可形成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述错误的是( )
A . 四种元素的原子半径大小顺序为:  B . 元素X、Y形成的简单离子具有相同的电子层结构
C . X与Y两种元素组成的化合物中一定不含非极性共价键
D . 由X、Y和Z三种元素组成的化合物的水溶液可能呈中性
B . 元素X、Y形成的简单离子具有相同的电子层结构
C . X与Y两种元素组成的化合物中一定不含非极性共价键
D . 由X、Y和Z三种元素组成的化合物的水溶液可能呈中性
 B . 元素X、Y形成的简单离子具有相同的电子层结构
C . X与Y两种元素组成的化合物中一定不含非极性共价键
D . 由X、Y和Z三种元素组成的化合物的水溶液可能呈中性
B . 元素X、Y形成的简单离子具有相同的电子层结构
C . X与Y两种元素组成的化合物中一定不含非极性共价键
D . 由X、Y和Z三种元素组成的化合物的水溶液可能呈中性
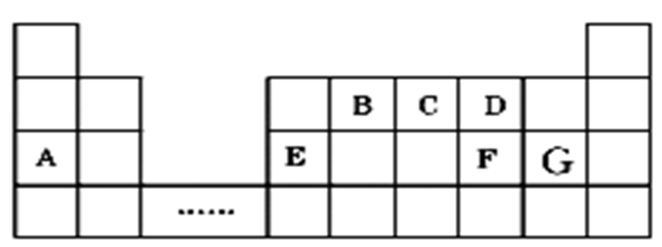
如图是元素周期表的一部分。表中所列的字母分别代表某一元素。
-
(1) 1mol A与D的简单氢化物完全反应时可产生标准状况下气体的体积为。
-
(2) 写出B的最高价氧化物对应的水化物的化学式。
-
(3) 其中含元素E化合物是一种白色胶状沉淀,可用于净水,则该物质的化学式为;
 与
与 的氢氧化物水溶液反应的化学方程式为。C的简单氢化物的电子式。
的氢氧化物水溶液反应的化学方程式为。C的简单氢化物的电子式。
-
(4) A、E、F、G形成的简单离子半径由大到小顺序(用离子符合表示)。
下列各组比较中,错误的是( )
A . 半径: 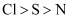 B . 热稳定性:
B . 热稳定性: 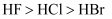 C . 酸性:
C . 酸性:  D . 还原性:
D . 还原性: 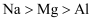
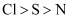 B . 热稳定性:
B . 热稳定性: 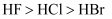 C . 酸性:
C . 酸性:  D . 还原性:
D . 还原性: 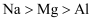
由短周期主族元素W、X、Y、Z构成的一种阴离子(如下图),W、X、Y、Z的原子序数依次增大,Z元素无正化合价。下列说法正确的是( )
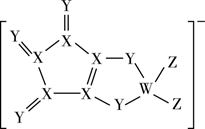
A . X与Y的氢化物沸点:Y>X
B . 原子半径大小关系是:Z>Y>X>W
C . 上图中各原子均满足8电子稳定结构
D . W的最高价氯化物对应的水化物是一种一元强酸
科学家为了解决电池的导电性问题,合成出了一种高效化合物,其结构如图1所示,其中W、Y、Z、X、Q均为短周期主族元素,其原子半径与原子序数的关系如图2,Z和Q位于同一主族。下列说法错误的是 ( )

A . 简单离子的半径: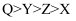 B . 第一电离能:
B . 第一电离能: C . 简单氢化物分子的键角:
C . 简单氢化物分子的键角: D . W、X、Q均可与Z形成两种常见的二元化合物
D . W、X、Q均可与Z形成两种常见的二元化合物
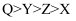 B . 第一电离能:
B . 第一电离能: C . 简单氢化物分子的键角:
C . 简单氢化物分子的键角: D . W、X、Q均可与Z形成两种常见的二元化合物
D . W、X、Q均可与Z形成两种常见的二元化合物
现有五种原子序数依次增大的短周期主族元素X、Y、Z、W、R,仅由X、Y两种元素形成的某化合物是天然气的主要成分;Z是短周期元素中原子半径最大的元素;W的最高价氧化物对应的水化物与Z、R的最高价氧化物对应的水化物都可以发生反应;X、R原子的最外层电子数之和等于Y、Z、W原子的最外层电子数之和。试回答下列问题:
-
(1) 天然气的主要成分的电子式为,该分子中的化学键为(填“极性”或“非极性”)共价键。
-
(2) 五种元素的原子半径由大到小的顺序为(填元素符号);Z、W、R形成的简单离子的半径由大到小的顺序为(填离子符号)。
-
(3) W的最高价氧化物对应的水化物与R的最高价氧化物对应的水化物在溶液中反应的离子方程式为。
-
(4) 工业上冶炼Z的单质的原理为(填化学方程式)。
1919年卢瑟福用α粒子( He)轰击某原子核实现了首次人工核转变,核反应为
He)轰击某原子核实现了首次人工核转变,核反应为 He+
He+ X →
X → Y+
Y+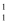 H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )
H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )
 He)轰击某原子核实现了首次人工核转变,核反应为
He)轰击某原子核实现了首次人工核转变,核反应为 He+
He+ X →
X → Y+
Y+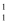 H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )
H。已知:Y 元素原子的最外层电子数为其内层电子总数的3倍。下列说法正确的是( )
A . 16Y2和17Y2互为同素异形体
B . X、Y的非金属性:X>Y
C . 最简单氢化物的沸点:Y<X
D . 仅由上述主族元素形成的化合物中可能含离子键
短周期主族元素X、Y、Z、W原子序数依次增大。基态X原子价电子层中的未成对电子有3个,Y是地壳中含量最多的元素,Z、W两元素最高正价之差的绝对值与Y原子最外层电子数相等。下列说法正确的是( )
A . 简单离子半径: B . Y与Z可形成含共价键的化合物
C . 第一电离能:
B . Y与Z可形成含共价键的化合物
C . 第一电离能: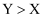 D . 由Y、Z、W形成的化合物的水溶液均显碱性
D . 由Y、Z、W形成的化合物的水溶液均显碱性
 B . Y与Z可形成含共价键的化合物
C . 第一电离能:
B . Y与Z可形成含共价键的化合物
C . 第一电离能: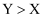 D . 由Y、Z、W形成的化合物的水溶液均显碱性
D . 由Y、Z、W形成的化合物的水溶液均显碱性
几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是( )
元素代号 | L | M | X | R | T |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
A . 离子半径大小:r(M3+) >r(T2-)
B . 其中R的金属性最强
C . 煤和石油中存在X元素
D . L、X形成的简单离子核外电子数相等
最近更新



