微粒半径大小的比较 知识点题库
下列说法中正确的是( )
①水分子的电子式为 ![]()
②离子半径由小到大的顺序是:Mg2+<Na+<Cl﹣<S2﹣
③氮分子的电子式为 ![]()
④只含有离子键的化合物才是离子化合物.
A . ①②
B . ③④
C . ①④
D . ②③
下列说法中正确的是( )
A . 分子中键能越大,键越长,则分子越稳定
B . 失电子难的原子获得电子的能力一定强
C . 在化学反应中,某元素由化合态变为游离态,该元素被还原
D . 电子层结构相同的不同离子,其半径随核电荷数增多而减小
下列化合物中,阴离子和阳离子的半径之比最小的是( )
A . CsF
B . NaF
C . LiI
D . KCl
下列粒子的半径关系正确的是( )
A . r(Na)>r(Mg)>r(Al)>r(K)
B . r(K+)>r(Ca2+)>r(S2﹣)>r(Cl﹣)
C . r(Na)>r(K)>r(Ca)>r(Mg)
D . r(F﹣)>r(Na+)>r(Mg2+)>r(Al3+)
短周期主族元素X、Y、Z、W原子序数依次增大,X的原子半径小于Y的原子半径,Z的单质是空气中含量最高的气体,W原子最外层比Y原子最外层少1个电子,W的单质制得的金属容器常温下可盛装浓硫酸。下列说法正确的是( )
A . 原子半径:r(Y)<r(Z)<r(W)
B . X、Y形成的化合物只含有极性键
C . Z、W的简单离子具有相同的电子层结构
D . Y的最高价氧化物的水化物酸性比Z的强
X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如下图所示。若Y原子的最外层电子数是次外层电子数的3倍,下列说法中正确的是( )

A . 原子半径:W>Z>Y>X
B . 最高价氧化物对应水化物的酸性:Z>W>X
C . 四种元素的单质中,W单质的熔沸点最高
D . W的单质能与水反应,生成一种具有漂白性的物质
短周期主族元素W、X、Y、Z的原子序数依次增大,W的原子序数是Z的原子序数的一半,W、X、Y三种元素形成的化合物M结构如图所示。下列叙述正确的是( )

A . 原子半径:Z>X>W
B . 气态氢化物的稳定性:Z>W>Y
C . Y的最高价氧化物的水化物可溶于X和Z的最高价氧化物的水化物
D . 化合物M中所有的原子均满足8电子稳定结构
中国科学院院士张青莲教授曾主持测定了铟(49In)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(37Rb)同周期。下列说法正确的是( )
A . In 是第四周期第IIA族元素
B .  的中子数与电子数的差值为27
C . 碱性:In(OH)3< RbOH
D . 原子半径:In<Al
的中子数与电子数的差值为27
C . 碱性:In(OH)3< RbOH
D . 原子半径:In<Al
 的中子数与电子数的差值为27
C . 碱性:In(OH)3< RbOH
D . 原子半径:In<Al
的中子数与电子数的差值为27
C . 碱性:In(OH)3< RbOH
D . 原子半径:In<Al
W、X、Y、Z是原子序数依次增大的短周期主族元素,W、Y分别与X形成的化合物均会导致酸雨。下列说法中一定正确的是( )
A . 简单离子半径中最大的是Z
B . 简单氢化物中熔沸点最高的是X
C . 氧化物对应水化物的酸性Z比Y强
D . W的氢化物分子含10个电子
M、W、X、Y、Z是同周期主族元素,X原子的最外层电子数是W原子次外层电子数的3倍。它们形成的化合物可用作新型电池的电极材料,结构如图所示,化合物中除M+外其它原子均满足8电子稳定结构。下列说法正确的是( )

A . M的单质通常保存在煤油中
B . 上述五种元素中Y的原子半径最小
C . Z的氢化物的沸点一定低于X氢化物的沸点
D . W的最高价氧化物对应的水化物是三元酸
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,X、Y价电子数之比为2∶3。W的原子半径在同周期主族元素中最小,金属单质Z在空气中燃烧生成的化合物可用作呼吸面具的供氧剂。下列说法错误的是( )
A . 原子半径X>Y,离子半径Z>Y
B . 化合物Z2Y存在离子键,ZWY中既有存在离子键又有共价键
C . X的简单氢化物与W的单质在光照下产生W的氢化物
D . Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
随着原子序数的递增,八种短周期元素(用字母x、y、z…表示)的原子半径的相对大小、最高正价或最低负价的变化如图所示。请根据判断出的元素回答下列问题。

-
(1) e元素周期表中的位置是。
-
(2) 比较d、e常见离子的半径大小:(用化学符号表示且用“>”连接,下同)。比较g、h的最高价氧化物对应的水化物的酸性强弱:。
-
(3) 写出x与z形成的常见四原子共价化合物的电子式。
-
(4) 物质A是一种常用的比水轻的有机溶剂,其仅由x、y两种元素组成,且x元素与y元素的质量比为
 ,A的相对分子质量为78,A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为。
,A的相对分子质量为78,A与浓硫酸、浓硝酸在50~60℃下发生反应的化学方程式为。
-
(5) 写出f元素最高价氧化物对应的水化物和e元素最高价氧化物对应的水化物之间发生的离子反应方程式。
A、B、C、D、E、F为六种短周期主族元素,它们的原子序数依次增大;A元素的原子半径最小;B元素原子的最外层电子数是次外层电子数的3倍;C与A同主族,且与E同周期;E元素的最外层电子数是次外层电子数的0.75倍,D既可与C的最高价氧化物的水化物反应,也可与E的最高价氧化物的水化物反应,均有A元素的单质生成。请回答下列问题:
-
(1) 写出F元素原子结构示意图,元素B在周期表中的位置。
-
(2) 判断C、D、E原子半径的大小顺序(填写元素符号,下同),比较B和E的气态氢化物的稳定性大小。
-
(3) 写出单质D与C的最高价氧化物的水化物反应的离子方程式。
-
(4) 由A、B、C、E四种元素共同构成的两种化合物在溶液中相互间可发生化学反应,试写出该反应的离子方程式。
 、
、  、
、  、
、 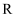 、
、  为原子序数依次增大的短周期元素,
为原子序数依次增大的短周期元素,  、
、  为同族元素,
为同族元素, 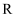 的原子半径是同周期主族元素中最大的。其中,
的原子半径是同周期主族元素中最大的。其中,  、
、  、
、  、
、  形成的化合物可表示为
形成的化合物可表示为  。下列说法正确的是( )
。下列说法正确的是( )
A . 原子半径:W>Z>Y
B . 简单氢化物的沸点:W>Z
C .  与
与  、
、  、
、 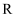 、
、  均可形成多种化合物
D .
均可形成多种化合物
D .  、
、 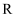 、
、  三种元素形成的化合物的水溶液呈中性
三种元素形成的化合物的水溶液呈中性
 与
与  、
、  、
、 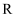 、
、  均可形成多种化合物
D .
均可形成多种化合物
D .  、
、 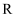 、
、  三种元素形成的化合物的水溶液呈中性
三种元素形成的化合物的水溶液呈中性
由短周期元素 、
、 、
、 、
、 组成的单质
组成的单质 、
、 、
、 、
、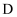 能发生如下反应,
能发生如下反应, 是短周期中原子半径最大的元素,
是短周期中原子半径最大的元素, 是地壳中含量最多的金属元素,
是地壳中含量最多的金属元素,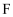 是淡黄色固体。下列说法错误的是( )
是淡黄色固体。下列说法错误的是( )
 、
、 、
、 、
、 组成的单质
组成的单质 、
、 、
、 、
、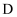 能发生如下反应,
能发生如下反应, 是短周期中原子半径最大的元素,
是短周期中原子半径最大的元素, 是地壳中含量最多的金属元素,
是地壳中含量最多的金属元素,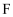 是淡黄色固体。下列说法错误的是( )
是淡黄色固体。下列说法错误的是( )
A . 原子半径大小: B . 最高价氧化物对应水化物的碱性强弱:
B . 最高价氧化物对应水化物的碱性强弱: C .
C . 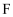 中阴阳离子个数比为
中阴阳离子个数比为 D .
D . 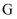 中既含有离子键又含有共价键
中既含有离子键又含有共价键
 B . 最高价氧化物对应水化物的碱性强弱:
B . 最高价氧化物对应水化物的碱性强弱: C .
C . 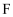 中阴阳离子个数比为
中阴阳离子个数比为 D .
D . 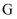 中既含有离子键又含有共价键
中既含有离子键又含有共价键
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与Y同主族,下列说法正确的是( )
A . X在元素周期表中的位置为第二周期第ⅣA族
B . Y分别与Z、W形成的化合物中化学键类型相同
C . 原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X)
D . W的氧化物对应的水化物都是强酸
有X、Y、Z三种短周期元素,对应离子 、
、 、
、 具有相同的电子层结构。下列说法正确的是( )
具有相同的电子层结构。下列说法正确的是( )
 、
、 、
、 具有相同的电子层结构。下列说法正确的是( )
具有相同的电子层结构。下列说法正确的是( )
A . 原子序数:Z>X> Y
B . X与Y可形成X2Y2型化合物
C . Z元素只存在正价
D . 还原性:

现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是( )
①1s22s2p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
A . 第一电离能:④>③>①>②
B . 原子半径:②>①>③>④
C . 电负性:④>①>③>②
D . 最高正化合价:④>③=②>①
短周期主族元素X、Y、Z、W、M的原子序数依次增大,其中X与其他元素均不位于同一周期,Y和W的原子序数相差8,Y、Z、W三种原子的最外层电子数之和为16,X、Z的最高正价和最低负价的代数和均为0。下列说法正确的是( )
A . X和Y、W和M均可能形成原子个数比为1:1的分子
B . 原子半径的大小顺序:r(W)>r(Z)>r(Y)
C . 最高价氧化物对应的水化物的酸性:M<W
D . 化合物的稳定性:ZX4>XM
X、Y、Z、W四种短周期主族元素原子序数依次增大,X和Z同主族且形成的单质在常温下状态不同,Y原子的最外层电子数是次外层电子数的2倍,W是地壳中含量最多的金属元素。下列说法正确的是( )
A . 原子半径:W>Z>Y
B . X与Z形成共价化合物
C . Y的氧化物对应的水化物为强酸
D . Z、W的氢氧化物可发生反应
最近更新



