微粒半径大小的比较 知识点题库
已知下列元素的原子半径:
元素 | N | S | O | Si |
原子半径/10﹣10 m | 0.75 | 1.02 | 0.74 | 1.17 |
根据以上数据,磷元素的原子半径可能是( )
A . 1.10×10﹣10m
B . 0.80×10﹣10m
C . 1.20×10﹣10m
D . 0.70×10﹣10m
下列各组微粒半径大小的比较,错误的是( )
A . K>Na>Li
B . Na+>Mg2+>O2﹣
C . P>S>O
D . Cl﹣<Br﹣<I﹣
W、X、Y、Z均为的短周期元素,原子序数依次增加,W的原子核外最外层电子数是次外层的2倍,X-、Y+具有相同的电子层结构,Z的阴离子不能发生水解反应。下列说法正确的是( )
A . 原子半径:Y>Z>X>W
B . 简单氢化物的熔沸点:Z>X>W
C . X与Y两种元素组成的化合物是离子化合物
D . 最高价氧化物的水化物的酸性:W <Z<X
以下有关元素性质的说法错误的是( )。
A . 具有下列电子排布式的原子中,①1s22s22p63s23p2 ②1s22s22p3 ③1s22s22p2 ④1s22s22p63s23p4 原子半径最大的是①
B . 具有下列价电子排布式的原子中,①3s23p1 ②3s23p2 ③3s23p3 ④3s23p4第一电离能最大的是③
C . ①Na、K、Rb②N、P、As③O、S、Se ④Na、P、Cl,元素的电负性随原子序数增大而递增的是④
D . 某元素气态基态原子的逐级电离能(kJ·mol-1)分别为738、1 451、7 733、10 540、13 630、17 995、21703,当它与氯气反应时可能生成的阳离子是X3+
下列排列顺序错误的是()
A . 酸性:H4SiO4<H3PO4<H2SO4<HClO4
B . 碱性:Ca(OH)2>Mg(OH)2>Al(OH)3
C . 原子半径:F<O<S<Na
D . 氢化物的稳定性:SiH4>H2S>H2O>HF
氟是卤族元素中原子半径最小的元素,氟的化合物种类繁多,用途广泛。回答下列问题:
-
(1) 基态氟原子价电子的电子排布图(轨道表达式)为,其电子占据的最高能级的电子云轮廓图为。
-
(2) NaF和MgF2均为离子晶体,其熔沸点如下表:

Na+、Mg2+、F-的离子半径大小顺序为,MgF2熔沸点比NaF高的原因是。
-
(3) 氟虫腈是一种广谱性杀虫剂,其结构简式如下图甲:

氟虫腈中碳原子的杂化方式为,氟虫腈晶体中存在(填标号)。
a.离子键 b.π键 c.非极性键 d.氢键 e.极性键
-
(4) 全氟辛酸(如上图乙)主要用作表面活性剂、乳化剂。全氟辛酸结构中,与每个碳原子(除羧基碳外)相连的F、C的空间构型为,构成该物质的C、O、F的第一电离能强弱为。
-
(5) PbF2具有萤石结构晶胞如上图两所示。每个Pb2+周围等距且紧邻的F-有个。已知晶胞参数为anm,阿伏加德罗常数的值为NA , 则PbF2的密度为g/cm3。
第三周期的三种元素甲、乙、丙,原子序数依次增大,且原子核外都有1个未成对电子,下列说法错误的是( )
A . 金属性:甲>乙>丙
B . 三种元素的单质都能与水反应
C . 离子半径:甲>乙>丙
D . 最高价氧化物对应水化物可两两相互反应
已知X、Y、Z、W原子序数都不超过18,它们的离子aX(n+1)+、bYn+、cZ(n+1)-、dWn-具有相同的电子层结构,则下列说法正确的是( )
A . 原子序数:a>b>c>d
B . 离子半径:X(n+1)+>Yn+>Z(n+1)->Wn-
C . 离子氧化性:X(n+1)+< Yn+
D . 单质氧化性:Z<W
A、B、C、D四种元素,已知A元素是地壳中含量最多的元素;B元素为金属元素,它的原子核外K、L层上电子数之和等于M、N层电子数之和;C元素是第三周期第一电离能最小的元素;D元素在第三周期中第一电离能最大。下列有关叙述错误的是( )
A . 四种元素A,B,C,D分别为O、Ca、Na、Ar
B . 元素A,B,C两两组成的化合物可为CaO、CaO2、Na2O、Na2O2等
C . 元素A,C简单离子的半径大小关系为A<C
D . 元素B,C电负性大小关系为B>C
短周期中8种元素a~h,其原子半径、最高价或最低价随原子序数递增的变化如图所示。

下列判断正确的是( )
A . a、d、f组成的化合物能溶于氨水
B . a可分别与b或c组成含18个电子的分子
C . e的阳离子半径比g的阴离子半径大
D . 最高价氧化物对应水化物的酸性:b>g>h
X、Y、Z、R、Q、M是六种短周期元素,原子序数依次增大。X是原子半径最小的元素,Y的气态氢化物能使湿润的红色石蕊试纸变蓝,Z为地壳中含量最高的元素,R与X同主族;Y、R、Q最外层电子数之和为8,M的单质是黄绿色有毒气体。请回答下列问题:
-
(1) R在元素周期表中的位置为。
-
(2) R2Z2的电子式为。
-
(3) X、Z两元素形成原子个数比为1:1的化合物中含有的化学键类型为 (填写“离子键”或“共价键”)
-
(4) Z、Q、M简单离子半径由大到小的顺序为 (写元素离子符号)。
-
(5) M的单质与R的最高价氧化物对应水化物反应的离子方程式为。
-
(6) 由X、Y、Z三种元素形成的盐类化合物的水溶液呈酸性的原因: (用离子方程式表示)。
X、Y、Z、R、W为常见的主族元素,根据下表信息回答问题:
|
元素 |
元素性质或原子结构信息 |
|
X |
短周期元素原子半径最大(稀有气体元素不参与比较) |
|
Y |
+3价阳离子的核外电子排布与氖原子相同 |
|
Z |
Z 元素的单质为淡黄色固体 |
|
R |
与Z同周期,主要化合价为−1、+7 |
|
W |
原子结构示意图: |
-
(1) 写出元素R的离子结构示意图;元素W在周期表中位置为。
-
(2) X、Y、Z、R元素形成的四种简单离子半径由大到小顺序为(用离子符号表示)。
-
(3) R的最高价氧化物对应水化物的化学式为,与X的最高价氧化物对应水化物反应的离子方程式为。
-
(4) 用电子式表示X和Z形成化合物的过程:。
-
(5) 下列对于W及其化合物的推断中,正确的是________(填序号)。A . W的最低负化合价与Z的最低负化合价相同 B . W的氢化物的稳定性弱于R的氢化物的稳定性 C . W的最高价氧化物对应水化物的酸性比Z的强 D . W的非金属性介于Z和R之间
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示,已知:四种原子最外层电子数之和为24。下列说法正确的是( )
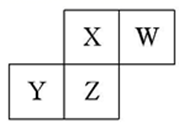
A . 元素Ⅹ和元素Z的最高正化合价相同
B . 单核阴离子半径的大小顺序为:r(W)>r(X)
C . 气态简单氢化物的热稳定性顺序为:Y<Z<X<W
D . 元素Z的氧化物对应水化物都是强酸
主族元素Q、R、X、Y、Z的原子序数依次增大,且不超过20,Q原子最外层电子数是内层电子数的2倍,R、X、Y均在同一周期,R最外层电子数与最内层电子数相等,Z与R为同主族,X的单质在空气中燃烧所得产物能使品红褪色。则下列说法正确的是( )
A . 原子半径大小的顺序:r(R)>r(X)>rY>r(Z)
B . R的最高价氧化物对应水化物的碱性比Z的强
C . Q元素在自然界中只存在一种单质
D . 元素X的简单氢化物的热稳定性比Y的弱
现有短周期主族元素X、Y、Z、R和T,原子序数依次增大。X的电子只有一种自旋取向,Y原子价电子数是能层数的2倍,R、T均为s能级与p能级电子总数相等的原子。下列推断正确的是( )
A . 离子半径: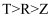 B . 电负性:
B . 电负性: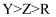 C . 第一电离能:
C . 第一电离能: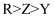 D . X和R形成的化合物可能含非极性键
D . X和R形成的化合物可能含非极性键
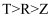 B . 电负性:
B . 电负性: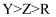 C . 第一电离能:
C . 第一电离能: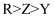 D . X和R形成的化合物可能含非极性键
D . X和R形成的化合物可能含非极性键
W、X、Y、Z为原子序数依次增大的短周期元素,其中W、X、Z分别位于不同周期,1个W2X分子含有10个电子,Y元素原子半径是同周期元素中最大的,Z元素原子的最外层电子数是次外层的二分之一,下列说法正确的是( )
A . 原子半径:r(Z)>r(Y)>r(X)>r(W)
B . 失电子能力:Y>W>X
C . Z的简单氢化物热稳定性比X的强
D . 采用电解Y的氯化物水溶液方法制取单质Y
某种化合物的结构如图所示。其中X、Y、Z、Q、W为原子序数依次增大的五种短周期主族元素,Q核外最外层电子数与Y核外电子总数相同,X的原子半径是元素周期表中最小的,下列说法正确的是( )
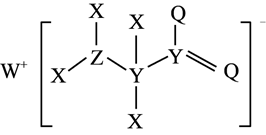
A . 电负性:Z>Q>Y
B . 简单离子半径:W>Z>Q
C . 该化合物中Z原子和Y原子都是  杂化
D . Y的氢化物沸点可能大于Q的氢化物沸点
杂化
D . Y的氢化物沸点可能大于Q的氢化物沸点
 杂化
D . Y的氢化物沸点可能大于Q的氢化物沸点
杂化
D . Y的氢化物沸点可能大于Q的氢化物沸点
A、B、D、E、G为原子序数依次增大的五种短周期主族元素,非金属元素A最外层电子数与其周期数相同,B原子的最外层电子数是其所在周期数的2倍。B单质在D单质中充分燃烧能生成其最高价化合物 ,
,  与
与 具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
 ,
,  与
与 具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
具有相同的电子层结构。A单质在G单质中燃烧,产物溶于水得到一种强酸。回答下列问题:
-
(1) G在元素周期表中的位置是,
 的电子式为;
的电子式为;
-
(2) D、E、G分别形成的简单离子的半径由大到小的顺序为(用离子符号表示);
-
(3) 由A、D、E三种元素组成的化合物含有的化学键类型为;
-
(4) 设计一个简单的实验证明G和B的非金属性强弱:(用化学方程式表示)。
X、Y、Z、W为四种短周期元素,有关这四种元素的说法中一定正确的是( )
元素 | X | Y | Z | W |
原子半径(nm) | 0.077 | 0.075 | 0.102 | 0.099 |
最高正价或最低负价 | +4 | +5 | -2 | -1 |
A . X与W形成XW4时,各原子最外层均满足8电子稳定结构,
B . 1molW的单质参加氧化还原反应时转移的电子数为2mol
C . 0.3molCu分别与足量HYO3和H2ZO4的稀溶液反应均产生0.2mol气体
D . Y的氢化物与W的氢化物反应的产物只含有共价键
中国科学院院士张青莲主持测定的铟( )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(
)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(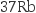 )同周期。下列说法错误的是( )
)同周期。下列说法错误的是( )
 )等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(
)等9种元素相对原子质量的新值,被采用为国际新标准。铟与铷(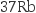 )同周期。下列说法错误的是( )
)同周期。下列说法错误的是( )
A .  是第五周期第III
是第五周期第III 族元素
B . 原子半径:
族元素
B . 原子半径: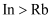 C .
C .  是
是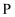 区元素
D . 第一电离能:
区元素
D . 第一电离能: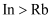
 是第五周期第III
是第五周期第III 族元素
B . 原子半径:
族元素
B . 原子半径: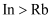 C .
C .  是
是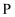 区元素
D . 第一电离能:
区元素
D . 第一电离能: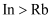
最近更新




