离子键的形成 知识点题库
下列物质中既有离子键又有共价键的是( )
A . H2SO4
B . Ca(OH)2
C . H2O2
D . CH3COOH
X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素原子的电子层结构时,X放出的能量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z.则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是( )
A . Z2X
B . Z2Y
C . W2X
D . W2Y
在下列物质中:①碘单质②烧碱晶体③NaCl晶体④干冰⑤固态氯化氢⑥Na2O2晶体.选择合适的物质,用序号填空:
(1)既含有离子键又含有非极性共价键的化合物是 .
(2)仅含有离子键的化合物是 .
(3)仅含有共价键的化合物是
下列说法中不正确的是( )
A . 金属和非金属原子之间一定形成离子键
B . 活泼的金属和活泼的非金属原子之间形成的化学键一定是离子键
C . 含有离子键的物质不可能是单质
D . 含有离子键的化合物一定是离子化合物
下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3 ⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
-
(1) 这些物质中,只含有共价键的是(填序号,下同);只含有离子键的是;既含有共价键又含有离子键的是;不存在化学键的是。
-
(2) 属于共价化合物的是;属于离子化合物的是。
-
(3) 将NaHSO4溶于水,破坏了NaHSO4中的,写出其电离方程式;
NaHSO4在熔融状态下电离,破坏了,写出其电离方程式。
下列说法正确的是( )
A . 共价化合物中可能含有离子键
B . 非金属原子不可能形成离子化合物
C . 不存在没有化学键的分子
D . 双原子单质分子中的共价键一定是非极性键
下列物质中,只有共价键的是( )
A . NaOH
B . NaCl
C . NH4Cl
D . H2O
下列说法正确的是()
A . HCl属于共价化合物,溶于水能电离出H+和Cl-
B . NaOH是离子化合物,该物质中只含离子键
C . HI气体受热分解的过程中,只需克服分子间作用力
D . 石英和干冰均为原子晶体
下列各元素,最易形成离子化合物的组合是( )
①第三周期第一电离能最小的元素 ②外围电子构型为2s22p6的原子 ③2p能级为半满的元素 ④电负性最大的元素
A . ①②
B . ③④
C . ②③
D . ①④
有关物质结构概念的判断正确的是( )
A . 离子键:阴阳离子间的静电吸引作用
B . 离子化合物:只含离子键的物质
C . 共价键:通过共用电子对产生的作用
D . 共价化合物:含有共价键的物质
下列物质中,既含共价键又含离子键的是( )
A . KCl
B . CO2
C . MgCl2
D . NaOH
氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3 , 主要用于制造炸药及用作分析试剂等。下列分析错误的是( )
A . 化合物Na3N是由离子键形成的
B . Na3N与过量的HCl(aq)反应,生成两种盐
C . 比较Na3N中两种粒子的半径:r(Na+)>r(N3-)
D . Na3N与水反应的化学方程式为Na3N+3H2O=3NaOH+NH3↑
下列各组物质中化学键的类型相同的是( )
A . HCl、MgCl2、NH4Cl
B . NH3、H2O、CO2
C . CO、Na2O、CS2
D . CaCl2、NaOH、N2O
下列说法中正确的是( )
①离子化合物中一定有离子键,可能有共价键
②NaHSO4固体中阳离子和阴离子的个数比是1:1
③非金属单质中不含离子键,一定只含共价键
④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A . ①②⑥
B . ①③④⑥
C . ①⑥
D . ①④⑤
X、Y、Z、W为短周期主族元素且原子序数依次增大,X原子在元素周期表中半径最小,有机物中都含有Y元素,Y、Z、W同周期,由四种元素形成的一种化合物甲的结构如图所示。下列说法错误的是( )
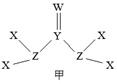
A . 最高化合价:W> Z>Y> X
B . (YZ)2和YW2均为直线型分子
C . 化合物甲的一种同分异构体可能既有离子键又有共价键
D . X分别与Y、Z、W形成电子总数为10的分子,沸点最高的是X2W
“中国芯”的主要原材料是高纯度单晶硅,反应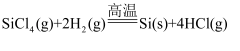 可用于纯硅的制备。SiCl4中存在的键型是( )
可用于纯硅的制备。SiCl4中存在的键型是( )
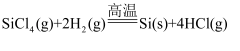 可用于纯硅的制备。SiCl4中存在的键型是( )
可用于纯硅的制备。SiCl4中存在的键型是( )
A . 极性共价键
B . 非极性共价键
C . 离子键
D . 共价键和离子键
某化合物结构如图所示。其中X、Y、W、Z是原子序数依次增大的短周期主族元素,W的最外层电子数是Y的最外层电子数的2倍,Z和X同主族。下列说法错误的是( )

A . 原子半径:Z>Y>W>X
B . W与Z形成的化合物中可能既有离子键,又有共价键
C . 该化合物中除X原子外,其它原子都满足8电子稳定结构
D . Y的最高价氧化物对应水化物是一种弱酸
下列叙述不正确的是( )
A . 离子化合物可能含有共价键
B . 共价化合物不可能含有离子键
C . 所有物质中均存在化学键
D . 35Cl、37Cl各为Cl元素的一种核素
下列说法正确的是( )
A . HCl气体和蔗糖溶于水时,都破坏了共价键
B . H2O、H2S、H2Se的相对分子质量依次增大,熔点依次增大
C . NaOH和K2SO4的化学键类型和晶体类型相同
D . 干冰容易升华,是由于干冰中的共价键强度较弱
下列说法中正确的是( )
A .  含离子键,在熔融状态下能导电
B .
含离子键,在熔融状态下能导电
B .  轨道上的电子一定比
轨道上的电子一定比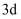 轨道能量高
C . 价电子越多的金属元素的金属性越强
D . 第四周期元素的基态原子中,未成对电子数最多的是
轨道能量高
C . 价电子越多的金属元素的金属性越强
D . 第四周期元素的基态原子中,未成对电子数最多的是
 含离子键,在熔融状态下能导电
B .
含离子键,在熔融状态下能导电
B . 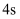 轨道上的电子一定比
轨道上的电子一定比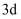 轨道能量高
C . 价电子越多的金属元素的金属性越强
D . 第四周期元素的基态原子中,未成对电子数最多的是
轨道能量高
C . 价电子越多的金属元素的金属性越强
D . 第四周期元素的基态原子中,未成对电子数最多的是
最近更新



