高中 化学
| A | B | C | D | |
| 强电解质 | Cu | NaCl | CaCO3 | HNO3 |
| 弱电解质 | CO2 | H2CO3 | H3PO4 | NH3 |
| 非电解质 | 蔗糖 | SO2 | H2O | BaSO4 |
-
(1) 基态铜原子的电子排布式为。
-
(2) 配合物Cu(NH3)2]Ac所含元素中,电负性最小的是 (填元素符号,下同);基态原子的第一电离能最大的是。
-
(3) [Cu(NH3)3CO]+的中心原子的配位数为。
-
(4) 在一定条件下NH3与CO2能合成尿素Co(NH2)2 ],尿素中C原子和N原子的轨道杂化类型分别为 、 ;1 mol尿素分子中,σ键的数目为NA。
-
(5) N、P、As属于同族元素,它们的最简单氢化物的沸点由大到小的顺序为(用化学式表示),其原因是。
-
(6) 铜的化合物种类很多,其中氯化亚铜的晶胞结构如图所示。

①晶胞内的4个Cl-相互连接所形成的立体构型是。
②已知晶胞的棱长为a nm,阿伏加德罗常数的值为NA , 则氯化亚铜的密度ρ= ( 填计算式即可)g·cm-3。
-
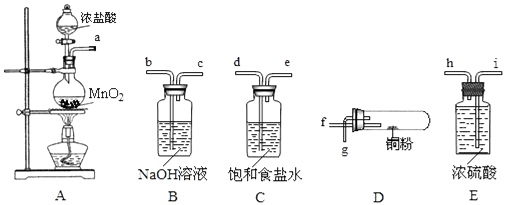
(1) 装置A烧瓶中发生反应的化学方程式为.
-
(2) 按气流方向连接各仪器接口的顺序是(填接口字母):
a→.
-
(3) 装置C中饱和食盐水的作用是.
-
(4) 装置B中发生反应的离子方程式为.
-
(5) 加热装置D时,铜粉发生反应的化学方程式为.

-
(1) 实验过程中看到的现象是.
-
(2) 小明认为该实验方案不完整,还需验证鸡蛋壳的主要成分属于钙盐,方法是取反应后的上层清液加入()(填字母).
A . Na2CO3溶液 B . AgNO3溶液 C . NaCl溶液 D . Ca(OH)2溶液 -
(3) 鸡蛋壳与盐酸反应的化学方程式为.
 和
和  B .
B .  和
和  C .
C .  和
和  D .
D . 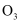 和
和 
-
(1) 乙炔的结构简式是。
-
(2) 用电子式表示K2S的形成过程:。
-
(3) 写出Al与NaOH溶液反应的离子方程式。
-
(4) 大多数有机物难溶于水,但乙醇作能与水以任意比混溶的主要原因是:。
①2H2(g)+O2(g)=2H2O(l) ΔH1=-571.8 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g) ΔH2=-192.9 kJ·mol-1
-
(1) 甲醇蒸气完全燃烧的热化学方程式为。
-
(2) 反应②中的能量变化如图
 ,
,
该反应为(吸或放)热反应,ΔH2=。(用E1、E2表示)
-
(3) H2(g)的燃烧热为。
选项 | 实验操作 | 现象 | 结论 |
A | 取少量待检验溶液于试管中,先加过量稀硝酸,再滴入少量硝酸银溶液 | 溶液中产生白色沉淀 | 溶液中含有Cl- |
B | 取已灼烧干净的铂丝醮取少量待检验溶液,放在酒精灯外焰上灼烧 | 火焰呈黄色 | 溶液中含有Na+ |
C | 取少量待检验溶液于试管中,滴入几滴酸性高锰酸钾溶液 | 高锰酸钾溶液褪色 | 溶液中含有Fe2+ |
D | 取少量待检验溶液于试管中,滴入几滴硫氰化钾溶液 | 溶液马上变红 | 溶液中含有Fe3+ |
二硫化碳(CS2,标况下为液体)能够在氧气中完全燃烧生成CO2和SO2,今用0.228g CS2在448mL O2(在标准状况下)中完全燃烧,反应后气体混合物在标准状况下的体积是( )
A.112mL B.224mL C.336mL D.448mL
近几年科学家发明的一种新型可控电池——锂水电池, 工作原理如图所示。
下列有关说法不正确的是( )
A.  石墨极发生的反应是2H2O+2e— === H2↑+2OH—
石墨极发生的反应是2H2O+2e— === H2↑+2OH—
B. 有机电解质和水溶液不可以互换区域
C. 该装置不仅可提供电能,还可得到清洁的氢气
D. 标准状况下产生22.4 L的氢气时,正极消耗锂的
质量为14 g
下列说法中正确的是 ( )
A.ⅠA、ⅡA族元素的原子,其半径越大,越难失去电子
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.原子及其离子的核外电子层数等于该元素所在的周期数
D.所有主族元素的原子,都能形成单原子离子
某气态的烷烃与烯烃的混合气体9g,其密度为同状况下H2密度的11.25倍,将混合气体通过足量的溴水,溴水增重4.2g,则原混合气体的组成为( )
A. 甲烷,乙烯 B. 乙烷,乙烯
C. 甲烷,丙烯 D. 甲烷,丁烯
铜、银和金是日常生活中常用金属
(1)基态铜原子的价层电子排布式为___________.
(2)银氨溶液主要成分是[Ag(NH3)2]OH,配制方法是,向AgNO3溶液中滴加氨水至沉淀刚好完全溶解为止,得到澄清的银氨溶液
①AgNO3中阴离子的空间构型是_______________;
②[Ag(NH3)2]+中银离子的配位数为___________;NH3分子中N的杂化类型是__________。
③与NH3互为等电子体的离子有:_____________。
(3)现代工业冶金中,2Au(CN)2-+Zn====2Au+Zn(CN)42-。CN-是常见的配体,提供孤电子对是C不是N,其主要原因是_________________________________。
(4)铜、银是有机反应常见的催化剂如 CH3CH2OH
(5)一种铜镍合金(俗称白铜)的晶胞如图1所示,铜、镍原子个数比为___________。

(6)金晶胞如图2所示,这种晶体堆积方式称为___________堆积。该晶胞中原子空间利用率(
A. 元素A的氢化物都是气体
B. 简单离子半径:C>D>B元素
C. B、C形成的化合物与水反应可以生成一种刺激性气味的气体
D. 元素B的气态氢化物的水溶液能溶解单质D



