高中 化学
 B . 实验室制取蒸馏水
B . 实验室制取蒸馏水  C . 从饱和食盐水中提取氯化钠晶体
C . 从饱和食盐水中提取氯化钠晶体  D . 分离酒精和水
D . 分离酒精和水 
 Na++Cl﹣
B . 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
C . 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑
D . 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
Na++Cl﹣
B . 氢氧化铁沉淀溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O
C . 石灰水表面漂着的“白膜”可用醋酸溶解:CaCO3+2H+═Ca2++H2O+CO2↑
D . 向硫酸氢钠溶液中滴加氢氧化钡溶液至刚好为中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O
①配制一定物质的量浓度的溶液 ②pH试纸的使用 ③过滤 ④蒸发.
①天然气 ②煤 ③燃料电池 ④太阳能 ⑤生物质能 ⑥风能 ⑦氢能.
 由太阳能电池电解水得到,能量转化形式为:太阳能→电能→化学能
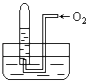
D . 空间站中
由太阳能电池电解水得到,能量转化形式为:太阳能→电能→化学能
D . 空间站中 和
和 反应制得水,既解决了
反应制得水,既解决了 的清除问题,又实现了水的循环利用
的清除问题,又实现了水的循环利用
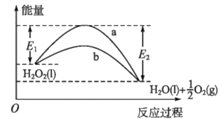
 O2(g)时,能量降低
D . 加催化剂后,正反应速率加快,逆反应速率减小
O2(g)时,能量降低
D . 加催化剂后,正反应速率加快,逆反应速率减小
 为强酸
B . 可溶性正盐BA溶液呈中性,该盐一定为强酸强碱盐
C . 将浓度为0.10
为强酸
B . 可溶性正盐BA溶液呈中性,该盐一定为强酸强碱盐
C . 将浓度为0.10 的醋酸溶液稀释,电离平衡正向移动,
的醋酸溶液稀释,电离平衡正向移动, 减小
D . pH=10.0的
减小
D . pH=10.0的 溶液中水电离出
溶液中水电离出 的物质的量为1.0×10-4mol
的物质的量为1.0×10-4mol
 通入
通入 溶液中:
溶液中: B . 用醋酸除去水垢中的碳酸钙:
B . 用醋酸除去水垢中的碳酸钙: C . 氯气通入水中:
C . 氯气通入水中: D . 铁与稀盐酸反应:
D . 铁与稀盐酸反应:
按要求回答下列问题:
(1)在下列物质中:①NaOH ②Na2O2 ③(NH4)2S ④CCl4 ⑤H-C≡C-H ⑥SiC ⑦晶体硅。含有非极性键的分子晶体是______,既有离子键,又有极性键和配位键的离子晶体是_____,原子晶体中熔点较高的是______(以上均填写序号)。
(2)甲醇是一种重要的化工原料,有着重要的用途和应用前景。工业上一般采用下列两种反应合成甲醇:
反应I:CO(g) + 2H2(g) ![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应II: CO2(g) + 3H2(g) ![]() CH3OH(g) +H2O(g) ΔH2
CH3OH(g) +H2O(g) ΔH2
①上述反应中原子利用率百分之百的是____(填“I”或“Ⅱ”)
②下表所列数据是反应I在不同温度下的化学平衡常数(K)
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1________0,T℃时,将2 mol CO和6 molH2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,此时T为____________。
(3)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 =-566.0kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:________________。
原子序数由小到大排列的四种短周期元素X、Y、 Z、W四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。 M元素与X同主族,与W同周期。
(1)M元素是__________(填元素符号)。
(2)Z、W形成的气态氢物的稳定性为_______>________。(填化学式)
(3)写出M2Z2的电子式_________,写出M2Z2与水反应的离子方程式__________。
(4)由X、Y、Z、W四种元素中的三种组成的—种强酸,该强酸的稀溶液能与铜反应,离子方程式为
__________________________________。
(5)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1molA能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体B,该气体能与氯水反应。则A是__________
(填化学式).写出该气体B与氯水反应的离子方程式__________________________________________。(6)由X、Y、 Z、W和Fe五种元素组成的相对分子质量为392的化合物C,1mol C中含有6mol结晶水。对化合物C进行下实验:
a.取C的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。过一段时间白色沉淀变为灰绿色,最终变为红褐色;
b.另取C的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解
①写出C的化学式为_______________________________________。
②试写出C与M2Z2按物质的量比1:2在溶液中反应的化学方程式____________________________。
某芳香族化合物H常用作防腐剂,H可利用下列路线合成:

已知:
①A是相对分子质量为92的烃;

④D的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积之比为1:1。
回答下列问题:
(1)A的分子式为___________,由A→B的反应试剂和反应条件为____________。
(2)写出C→D的反应方程式:_________________________________________。
(3)同时符合下列条件的E的同分异构体共有____________种。
①能发生银镜反应 ②能使FeCl3溶液发生显色反应。
(4)检验F中含氧官能团的试剂为____________(填试剂名称),由F→G的反应类型为
(5)H的结构简式为_____________________________________。
能正确表示下列反应的离子方程式是( )
A.过量的SO2通入NaOH溶液中:SO2+2OH-═SO32-+H2O
B.0.1 mol/L NH4Al(SO4)2溶液与0.2 mol/L Ba(OH)2溶液等体积混合:Al3++2SO![]() +2Ba2++4OH-===2BaSO4↓+AlO
+2Ba2++4OH-===2BaSO4↓+AlO![]() +2H2O
+2H2O
C.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO![]() +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.Fe2O3溶于过量氢碘酸溶液中:Fe2O3+6H++2I-===2Fe2++I2+3H2O
常温下,下列各组离子一定能大量共存的是( )
A.3% H2O2溶液中:Fe2+、H+、SO![]() 、Cl-
、Cl-
B.使甲基橙试液变红的溶液中:Al3+、Cu2+、NO![]() 、SO
、SO![]()
C.由水电离出的c(H+)=1.0×10-13mol·L-1的溶液中:Na+、CO![]() 、SO
、SO![]() 、Cl-
、Cl-
D.加铝粉能产生大量H2的溶液中:Na+、NH![]() 、NO
、NO![]() 、Cl-
、Cl-



