й«ҳдёӯ еҢ–еӯҰ
в‘ SO2дҪҝе“Ғзәўжә¶ж¶ІиӨӘиүІпјӣв‘ЎCl2дҪҝе“Ғзәўжә¶ж¶ІиӨӘиүІпјӣв‘ўNa2O2еҠ е…Ҙеҗ«й…ҡй…һзҡ„ж°ҙжә¶ж¶ІдёӯпјҢе…ҲеҸҳзәўеҗҺиӨӘиүІпјӣв‘ЈSO2дҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІ
в‘ҙ й’ дёҺж°ҙеҸҚеә”(зҰ»ж–№зЁӢејҸ)
в‘ө йҷӨеҺ»зўій…ёж°ўй’ е®№ж¶Ідёӯе°‘йҮҸзўій…ёй’ <зҰ»еӯҗж–№зЁӢејҸ)
⑶ йҷӨеҺ»зўій…ёй’ еӣәдҪ“ж··жңүзҡ„зўій…ёж°ўй’ (еҢ–еӯҰж–№зЁӢејҸ)
в‘· й•ҒеңЁдәҢж°§еҢ–зўідёӯзҮғзғ§(еҢ–еӯҰж–№зЁӢејҸ)
в‘ё дәҢж°§еҢ–зўідёӯж··жңүе°‘йҮҸж°ҜеҢ–ж°ў(зҰ»еӯҗж–№зЁӢејҸ)
IпјҺеҮҶеӨҮKMnO4ж ҮеҮҶжә¶ж¶І
aпјҺй…ҚеҲ¶100.00mLKMnO4жә¶ж¶ІеӨҮз”Ёпјӣ
bпјҺеҮҶзЎ®з§°еҸ–Na2C2O4еҹәеҮҶзү©иҙЁ3.35g(0.025mol)пјҢй…ҚеҲ¶жҲҗ250.00mLж ҮеҮҶжә¶ж¶ІгҖӮеҸ–еҮә25.00mLдәҺй”ҘеҪўз“¶дёӯпјҢеҠ е…ҘйҖӮйҮҸ3 molвҲҷLвҲ’1зЎ«й…ёй…ёеҢ–еҗҺпјҢз”Ёеҫ…ж Үе®ҡзҡ„KMnO4жә¶ж¶Іж»ҙе®ҡиҮіз»ҲзӮ№пјҢи®°еҪ•ж•°жҚ®пјҢи®Ўз®—KMnO4жә¶ж¶Ізҡ„жө“еәҰгҖӮ
IIпјҺж»ҙе®ҡдё»иҰҒжӯҘйӘӨ
aпјҺеҸ–еҫ…жөӢеҸҢж°§ж°ҙ10.00mLдәҺй”ҘеҪўз“¶дёӯпјӣ
bпјҺй”ҘеҪўз“¶дёӯеҠ е…Ҙ30.00mLи’ёйҰҸж°ҙе’Ң30.00mL3 molвҲҷLвҲ’1зЎ«й…ёпјҢ然еҗҺз”Ёе·Іж Үе®ҡзҡ„KMnO4жә¶ж¶І(0.1000 molвҲҷLвҲ’1)ж»ҙе®ҡиҮіз»ҲзӮ№пјӣ
cпјҺйҮҚеӨҚдёҠиҝ°ж“ҚдҪңдёӨж¬ЎпјҢдёүж¬ЎжөӢе®ҡзҡ„ж•°жҚ®еҰӮиЎЁпјҡ
з»„еҲ« | 1 | 2 | 3 |
ж¶ҲиҖ—ж ҮеҮҶжә¶ж¶ІдҪ“з§Ҝ(mL) | 25.00 | 25.02 | 24.98 |
dпјҺж•°жҚ®еӨ„зҗҶгҖӮ
иҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
-
пјҲ1пјү е°Ҷз§°еҫ—зҡ„Na2C2O4й…ҚеҲ¶жҲҗ250.00mLж ҮеҮҶжә¶ж¶ІпјҢжүҖдҪҝз”Ёзҡ„д»ӘеҷЁйҷӨзғ§жқҜе’ҢзҺ»з’ғжЈ’еӨ–иҝҳжңүгҖӮ
-
пјҲ2пјү ж Үе®ҡKMnO4жә¶ж¶Іж—¶пјҢиғҪеҗҰз”ЁзЁҖзЎқй…ёи°ғиҠӮжә¶ж¶Ій…ёеәҰ(еЎ«вҖңиғҪвҖқжҲ–вҖңдёҚиғҪвҖқ)пјҢз®Җиҝ°зҗҶз”ұгҖӮеҶҷеҮәж Үе®ҡиҝҮзЁӢдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸгҖӮ
-
пјҲ3пјү ж»ҙе®ҡеҫ…жөӢеҸҢж°§ж°ҙж—¶пјҢж ҮеҮҶжә¶ж¶Іеә”иЈ…е…Ҙж»ҙе®ҡз®ЎпјҢж»ҙе®ҡиҮіз»ҲзӮ№зҡ„зҺ°иұЎжҳҜгҖӮ
-
пјҲ4пјү и®Ўз®—жӯӨеҸҢж°§ж°ҙзҡ„жө“еәҰдёәgвҲҷLвҲ’1гҖӮ
-
пјҲ5пјү иҜҜе·®еҲҶжһҗпјҡеңЁз¬¬IIжӯҘж»ҙе®ҡдё»иҰҒжӯҘйӘӨдёӯпјҢдёӢеҲ—ж“ҚдҪңдјҡдҪҝеҸҢж°§ж°ҙжө“еәҰжөӢе®ҡз»“жһңеҒҸй«ҳзҡ„жҳҜ____гҖӮA . й”ҘеҪўз“¶жҙ—еҮҖеҗҺз”ЁеҸҢж°§ж°ҙж¶Ұжҙ— B . ж»ҙе®ҡеүҚж»ҙе®ҡз®Ўе°–еҳҙйғЁеҲҶжңүж°”жіЎпјҢж»ҙе®ҡеҗҺж°”жіЎж¶ҲеӨұ C . и§ӮеҜҹиҜ»ж•°ж—¶пјҢж»ҙе®ҡеүҚд»°и§ҶпјҢж»ҙе®ҡеҗҺдҝҜи§Ҷ D . жҢҜиҚЎй”ҘеҪўз“¶ж—¶йғЁеҲҶж¶ІдҪ“жә…еҮә
 2SO3,дҪҝз”ЁеӮ¬еҢ–еүӮиғҪеҠ еҝ«еҸҚеә”йҖҹзҺҮе’ҢжҸҗй«ҳSO2е№іиЎЎиҪ¬еҢ–зҺҮ
2SO3,дҪҝз”ЁеӮ¬еҢ–еүӮиғҪеҠ еҝ«еҸҚеә”йҖҹзҺҮе’ҢжҸҗй«ҳSO2е№іиЎЎиҪ¬еҢ–зҺҮ
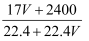 B . W=
B . W= 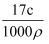 C . W=
C . W= 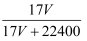 D . C=
D . C= 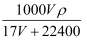
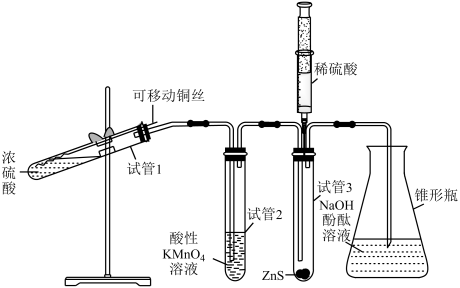
йҖүйЎ№ | д»ӘеҷЁ | зҺ°иұЎйў„жөӢ | и§ЈйҮҠжҲ–з»“и®ә |
A | иҜ•з®Ў1 | еҶ·еҚҙеҗҺпјҢжҠҠж¶ІдҪ“еҖ’е…Ҙж°ҙдёӯпјҢжә¶ж¶Ідёәи“қиүІ | й“ңиў«ж°§еҢ–пјҢиҪ¬еҢ–дёәCu2+ |
B | иҜ•з®Ў2 | зҙ«зәўиүІжә¶ж¶Із”ұж·ұеҸҳжө…пјҢзӣҙиҮіиӨӘиүІ | SO2е…·жңүиҝҳеҺҹжҖ§ |
C | иҜ•з®Ў3 | жіЁе…ҘзЁҖзЎ«й…ёеҗҺпјҢеҮәзҺ°й»„иүІжө‘жөҠ | SO2е…·жңүж°§еҢ–жҖ§ |
D | й”ҘеҪўз“¶ | жә¶ж¶ІзәўиүІеҸҳжө… | NaOHжә¶ж¶Іе®Ңе…ЁиҪ¬еҢ–дёәNaHSO3жә¶ж¶І |
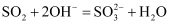 B . зўій…ёй’ҷеҠ е…ҘйҶӢй…ёжә¶ж¶Ідёӯпјҡ
B . зўій…ёй’ҷеҠ е…ҘйҶӢй…ёжә¶ж¶Ідёӯпјҡ 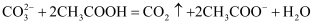 C . зўій…ёж°ўй’ жә¶ж¶ІдёҺзЁҖзЎқй…ёеҸҚеә”пјҡ
C . зўій…ёж°ўй’ жә¶ж¶ІдёҺзЁҖзЎқй…ёеҸҚеә”пјҡ  D . NaHSO4жә¶ж¶ІдёӯеҠ е…ҘBa(OH)2жә¶ж¶ІиҮіжә¶ж¶Іе‘ҲдёӯжҖ§пјҡ
D . NaHSO4жә¶ж¶ІдёӯеҠ е…ҘBa(OH)2жә¶ж¶ІиҮіжә¶ж¶Іе‘ҲдёӯжҖ§пјҡ 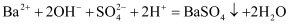
е·ІзҹҘпјҡ2NO(g)пјқN2(g)+O2(g) в–іHпјқ-180.5kJВ·mol-1
2H2O(l)пјқ2H2(g)+O2(g) в–іHпјқ+571.6kJВ·mol-1
еҲҷз”ЁH2еӮ¬еҢ–иҝҳеҺҹNOж¶ҲйҷӨжұЎжҹ“зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜгҖӮ
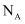 дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
дёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 е’Ң22.4L NOеңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶж··еҗҲеҗҺпјҢж°”дҪ“еҲҶеӯҗжҖ»ж•°е°ҸдәҺ
е’Ң22.4L NOеңЁеҜҶй—ӯе®№еҷЁдёӯе……еҲҶж··еҗҲеҗҺпјҢж°”дҪ“еҲҶеӯҗжҖ»ж•°е°ҸдәҺ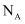 B .
B . 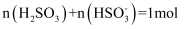 зҡ„
зҡ„ жә¶ж¶ІдёӯпјҢеҗ«жңү
жә¶ж¶ІдёӯпјҢеҗ«жңү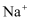 зҡ„ж•°зӣ®зӯүдәҺ
зҡ„ж•°зӣ®зӯүдәҺ C . 1L
C . 1L  зҡ„зәҜж°ҙдёӯеҗ«жңү
зҡ„зәҜж°ҙдёӯеҗ«жңү зҡ„ж•°зӣ®дёә
зҡ„ж•°зӣ®дёә D . з”өи§ЈзІҫзӮјй“ңж—¶пјҢиӢҘйҳіжһҒиҙЁйҮҸеҮҸе°‘64gпјҢеҲҷйҳҙжһҒеҫ—еҲ°з”өеӯҗзҡ„ж•°зӣ®дёә2
D . з”өи§ЈзІҫзӮјй“ңж—¶пјҢиӢҘйҳіжһҒиҙЁйҮҸеҮҸе°‘64gпјҢеҲҷйҳҙжһҒеҫ—еҲ°з”өеӯҗзҡ„ж•°зӣ®дёә2
CO(g)дёҺH2O(g)еҸҚеә”иҝҮзЁӢзҡ„иғҪйҮҸеҸҳеҢ–еҰӮдёӢеӣҫжүҖзӨәпјҢжңүе…ідёӨиҖ…еҸҚеә”зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖ пјү
 |
AпјҺиҜҘеҸҚеә”дёәеҗёзғӯеҸҚеә”
BпјҺCO(g)е’ҢH2O(g)зҡ„жҖ»з„“еӨ§дәҺCO2(g)е’ҢH2(g)зҡ„жҖ»з„“
CпјҺеҸҚеә”зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸжҳҜCO(g)+H2O(g)=CO2(g)+H2(g)В В в–іH=+41kJ/molВ В В В В В В В
DпјҺ1mol CO2(g)е’Ң1mol H2(g)еҸҚеә”з”ҹжҲҗ1molCO(g)е’ҢH2O(g)иҰҒж”ҫеҮә41kJзҡ„зғӯйҮҸ
еңЁе®№з§Ҝдёә2.0 Lзҡ„еҜҶй—ӯе®№еҷЁеҶ…пјҢзү©иҙЁDеңЁT в„ғж—¶еҸ‘з”ҹеҸҚеә”пјҢе…¶еҸҚеә”зү©е’Ңз”ҹжҲҗзү©зҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙtзҡ„еҸҳеҢ–е…ізі»еҰӮеӣҫпјҢдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ
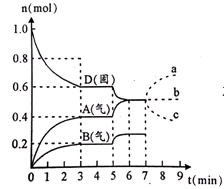
AпјҺд»ҺеҸҚеә”ејҖе§ӢеҲ°з¬¬дёҖж¬ЎиҫҫеҲ°е№іиЎЎж—¶пјҢAзү©иҙЁзҡ„е№іеқҮеҸҚеә”йҖҹзҺҮдёә0.0667 mol/(LВ·min)
BпјҺиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә2D(s)![]() 2A(g)+B(g)пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸдёәK=c(A)2В·c(B)
2A(g)+B(g)пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°иЎЁиҫҫејҸдёәK=c(A)2В·c(B)
CпјҺе·ІзҹҘпјҡеҸҚеә”зҡ„вҲҶHпјһ0пјҢеҲҷ第5еҲҶй’ҹж—¶еӣҫиұЎе‘ҲзҺ°дёҠиҝ°еҸҳеҢ–зҡ„еҺҹеӣ еҸҜиғҪжҳҜеҚҮй«ҳдҪ“зі»зҡ„жё©еәҰ
DпјҺиӢҘеңЁз¬¬7еҲҶй’ҹж—¶еўһеҠ Dзҡ„зү©иҙЁзҡ„йҮҸпјҢеҲҷиЎЁзӨәAзҡ„зү©иҙЁзҡ„йҮҸеҸҳеҢ–жӯЈзЎ®зҡ„жҳҜaжӣІзәҝ
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ WгҖҒXгҖҒYгҖҒZзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеҠ пјҢKгҖҒLгҖҒMеқҮжҳҜз”ұиҝҷдәӣе…ғзҙ з»„жҲҗзҡ„ж°§еҢ–зү©пјҢз”ІгҖҒд№ҷеҲҶеҲ«жҳҜе…ғзҙ XгҖҒYзҡ„еҚ•иҙЁпјҢз”ІжҳҜеёёи§Ғзҡ„еӣәдҪ“пјҢд№ҷжҳҜеёёи§Ғзҡ„ж°”дҪ“гҖӮKжҳҜж— иүІж°”дҪ“пјҢжҳҜдё»иҰҒзҡ„еӨ§ж°”жұЎжҹ“зү©д№ӢдёҖпјҢдёҷзҡ„жө“жә¶ж¶ІжҳҜе…·жңүејәж°§еҢ–жҖ§зҡ„й…ёжә¶ж¶ІпјҢдёҠиҝ°зү©иҙЁзҡ„иҪ¬еҢ–е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
A. з”өиҙҹжҖ§пјҡWпјһXпјһY
B. еҺҹеӯҗзҡ„第дёҖз”өзҰ»иғҪпјҡZ>Y>X
C. з”ұWгҖҒXгҖҒYгҖҒZжһ„жҲҗеҢ–еҗҲзү©дёӯеҸӘеҗ«е…ұд»·й”®
D. KгҖҒLгҖҒMдёӯжІёзӮ№жңҖй«ҳзҡ„жҳҜM
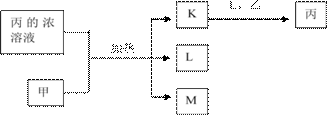
й…ҡйҶӣж ‘и„ӮжҳҜеә”з”Ёе№ҝжіӣзҡ„й«ҳеҲҶеӯҗжқҗж–ҷпјҢеҸҜз”Ёй…ҡзұ»дёҺйҶӣзұ»еңЁй…ёжҲ–зўұзҡ„еӮ¬еҢ–дёӢзӣёдә’зј©еҗҲиҖҢжҲҗпјҢзұ»дјјзҡ„еҗҲжҲҗиҝҮзЁӢеҰӮдёӢпјҡ
еҸҚеә”в‘ 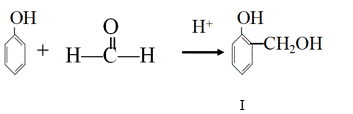
еҸҚеә”в‘Ў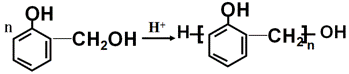 +пјҲn-1пјүH2O
+пјҲn-1пјүH2O
в‘ҙеҢ–еҗҲзү©в… зҡ„еҲҶеӯҗејҸ____________гҖӮ
в‘өиӢҜй…ҡдёҺжө“жәҙж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә_____________гҖӮ
⑶еҢ–еҗҲзү©в…Ў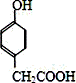 д№ҹиғҪдёҺCH3CHOеҸ‘з”ҹзұ»дјјеҸҚеә”в‘ зҡ„еҸҚеә”пјҢз”ҹжҲҗжңүжңәзү©в…ўпјҢиҜҘеҸҚеә”еҢ–еӯҰж–№зЁӢејҸдёә________________пјӣеҶҷеҮәжңүжңәзү©в…ЎдёҺи¶ійҮҸNaHCO3еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ_________гҖӮ
д№ҹиғҪдёҺCH3CHOеҸ‘з”ҹзұ»дјјеҸҚеә”в‘ зҡ„еҸҚеә”пјҢз”ҹжҲҗжңүжңәзү©в…ўпјҢиҜҘеҸҚеә”еҢ–еӯҰж–№зЁӢејҸдёә________________пјӣеҶҷеҮәжңүжңәзү©в…ЎдёҺи¶ійҮҸNaHCO3еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ_________гҖӮ
зҺ°жңүFe2O3 гҖҒCuOзҡ„ж··еҗҲзү©пјҢеңЁи¶ійҮҸH2ж°”жөҒдёӯпјҢеҠ зғӯе……еҲҶеҸҚеә”пјҢеҶ·еҚҙеҗҺз§°еҫ—еү©дҪҷеӣәдҪ“жҜ”еҺҹж··еҗҲзү©еҮҸиҪ»1.6 gпјӣиӢҘе°ҶзӯүиҙЁйҮҸзҡ„еҺҹж··еҗҲзү©дёҺзӣҗй…ёеҸҚеә”пјҢж¬ІдҪҝд№Ӣе®Ңе…Ёжә¶и§ЈпјҢйңҖ1 mol/Lзҡ„зӣҗй…ёзҡ„дҪ“з§ҜиҮіе°‘дёәпјҲгҖҖгҖҖпјү
AпјҺ0.05 LВ В В В В В В В В BпјҺ0.1 LВ В В В В В В В В В В CпјҺ0.2 LВ В В В В В В В В В DпјҺ0.4 L
еҸҚеә”4A(s)+3B(g)пјқ2C(g)+ D(g)пјҢз»Ҹ2 minпјҢBзҡ„жө“еәҰеҮҸе°‘дәҶ0.6 mol/LгҖӮеҜ№жӯӨеҸҚеә”йҖҹзҺҮзҡ„иЎЁзӨәжӯЈзЎ®зҡ„жҳҜ
AпјҺз”ЁAиЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮжҳҜ0.3 molВ·LвҲ’1В·minвҲ’1
BпјҺеҲҶеҲ«з”ЁBгҖҒCгҖҒDиЎЁзӨәзҡ„еҸҚеә”йҖҹзҺҮзҡ„жҜ”еҖјжҳҜ3﹕2﹕1
CпјҺеңЁ2 minжң«зҡ„еҸҚеә”йҖҹзҺҮпјҢз”ЁBиЎЁзӨәжҳҜ0.3 molВ·LвҲ’1В·sвҲ’1
DпјҺBе’ҢCзҡ„еҸҚеә”йҖҹзҺҮеҲҶеҲ«иЎЁзӨә2 minеҶ…еҗ„иҮӘзҡ„ж¶ҲиҖ—йҮҸ
дёӢеҲ—еҗ„з»„зү©иҙЁдә’дёәеҗҢдҪҚзҙ зҡ„жҳҜ В В В В В пјҲВ В В пјү
AпјҺO2е’ҢO3В В В В В В В В В В В В В В В В В В В В В В В В BпјҺ12H2е’Ң13H2В В В В В В
CпјҺ612Cе’Ң613CВ В В В В В В В В В В В В В В В В В В В DпјҺC2H5COOHдёҺCH3COOCH3
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯдёҖе®ҡиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ(гҖҖ гҖҖ)
AпјҺж°ҙз”өзҰ»еҮәзҡ„c(HпјӢ)В·c(OHпјҚ)пјқ10пјҚ22зҡ„жә¶ж¶ІпјҡKпјӢгҖҒNaпјӢгҖҒSO![]() гҖҒS2O
гҖҒS2O![]()
BпјҺжҫ„жё…йҖҸжҳҺжә¶ж¶ІпјҡMg2пјӢгҖҒCu2пјӢгҖҒClпјҚгҖҒSO![]()
CпјҺдҪҝй…ҡй…һеҸҳзәўиүІзҡ„жә¶ж¶ІпјҡNH![]() гҖҒKпјӢгҖҒAlO
гҖҒKпјӢгҖҒAlO![]() гҖҒNO
гҖҒNO![]()
DпјҺеҗ«0.1 molВ·LпјҚ1 KIзҡ„жә¶ж¶ІпјҡFe3пјӢгҖҒNaпјӢгҖҒNO![]() гҖҒClпјҚ
гҖҒClпјҚ



