高中 化学
-
(1) 基态钛原子的价层电子排布式为。
-
(2) 二氧化钛是世界上最白的物质,1g二氧化钛可以把450多平方厘米的面积涂得雪白,是调制白油漆的最好颜料。基态Ti4+中核外电子占据的原子轨道数为个。
-
(3) 四氯化钛是种有趣的液体,在潮湿空气中水解生成白色的二氧化钛水凝胶,军事上利用四氯化钛的这种“怪脾气”制造烟雾剂。写出四氯化钛水解的化学方程式。
-
(4) Ti(BH4)3是一种储氢材料,可由TiCl4和LiBH4反应制得。LiBH4由Li+和BH
 构成,其中BH
构成,其中BH 的空间构型为;B原子的杂化轨道类型为。
的空间构型为;B原子的杂化轨道类型为。
-
(5) Mn、Fe均为第四周期过渡金属元素,两元素的部分电离能数据如下:
元素
Mn
Fe
电离能/kJ∙mol−1
I1
717
759
I2
1509
1561
I3
3248
2957
锰元素位于第周期族区;比较两元素的I2、I3可知,气态Mn2+再失去1个电子比气态Fe2+再失去1个电子难,对此你的解释是。

 都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的
都是大气污染气体,在空气中都能稳定存在
B . 明矾在水中生成的 胶体有吸附性,因此常用明矾对水进行消毒
C .
胶体有吸附性,因此常用明矾对水进行消毒
C .  、
、 或
或 都会导致酸雨的形成
D . 活性炭、
都会导致酸雨的形成
D . 活性炭、 、
、 都能使品红溶液褪色,原理不同
都能使品红溶液褪色,原理不同
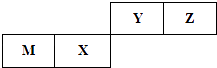
 。下列化学用语的使用正确的是( )
。下列化学用语的使用正确的是( )
 B .
B .  的电子式为
的电子式为  C . 碳的两种单质金刚石和石墨互为同位素
D .
C . 碳的两种单质金刚石和石墨互为同位素
D .  的比例模型为
的比例模型为 洗车安全气囊是德国安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。化合物丙与空气接触可转化为可溶性盐。
请回答下列问题:
(1)甲的化学式为 ,丙的电子式为 。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为 。
(3)单质乙与红棕色粉末发生反应的化学方程式为 ,安全气囊中红棕色粉末的作用是 。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是 。
A. KCl B. KNO3 C. Na2S D. CuO
(5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合物) 。
下列现象反映了硫酸的哪些主要性质:
(1)浓硫酸滴在木条上,过一会儿,木条变黑. .
(2)敞口放置浓硫酸时,质量增加. .
(3)锌粒投入稀硫酸中,有气泡产生. .
(4)铜片放入浓硫酸里加热,有气体产生. .
(5)浓硫酸可用铁制或铝制的容器储存和运输. .
向20mL某物质的量浓度的AlCl3溶液中滴加2mol/L NaOH溶液时,逐滴加入NaOH溶液直至过量.经测定,加入的NaOH溶液的体积(mL)和所得沉淀的物质的量(mol)的关系如图所示.则:
(1)写出OA段发生反应的离子方程式:OA段 ,图中线段OP:PB=________ ,
(2)计算原AlCl3溶液的物质的量浓度为________ mol/L,
(3)图中A对应的横坐标为________ mL,
(4)当加入5ml NaOH溶液时,产生沉淀量为________ mol,
(5)当加入的NaOH溶液过量时,使最初生成的沉淀部分溶解,要得到与(4)中相同的沉淀量,加入NaOH溶液的体积为________ml 。

下列各物质都属于极性分子的一组![]() 是( )
是( )
A.HF 、 NH3 、 CO 、 H2S B.NO 、 SO2 、 CCl4 、 H2O2
C.SO3 、 H2O 、 N2 、 SiF4 ![]() D.CO 、 BF3 、 CS2 、 PCl3
D.CO 、 BF3 、 CS2 、 PCl3
如图为元素周期表中短周期的一部分,关于Y、Z、M的说法正确的是( ![]() )
)
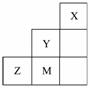
A.电负性:Y>Z>M
B.离子半径:M->Z2->Y-
C.ZM2分子中各原子的最外层均满足8电子稳定结构
D.Z元素基态原子最外层电子排布图为

下列气体实验室制备时,可以用相同发生装置的是
A.O2 HCl B.Cl2 H2 C.HCl Cl2 D.CO2 HCl
我国及美国、日本等国家都已研制出了一种陶瓷柴油机,这种柴油机的发动机部件的受热面是用一种耐高温且不易传热的材料来制造的,这种材料是
A.普通硅酸盐陶瓷 B.氮化硅陶瓷 C.光导纤维 D.玻璃钢
丁烷的一氯代物共有多少种
A.3 B.5 C.4 D.2
下列关于有机化合物的认识不正确的是
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
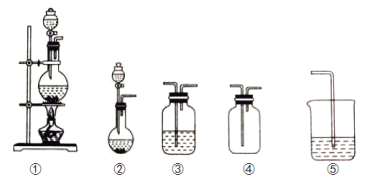
选项 | 实验目的 | 实验装置 | 实验药品 |
A | 制备并收集HCl气体 | ①③④ | 浓盐酸、浓硫酸、水 |
B | 比较氯气和溴的氧化性强弱 | ①③③⑤ | MnO2、浓盐酸、饱和食盐水、溴化钾溶液、氢氧化钠溶液 |
C | 探究乙烯的加成反应 | ①③ | 无水乙醇、浓硫酸、溴的四氯化碳溶液 |
D | 探究二氧化硫的还原性 | ②③③ | 亚硫酸钠、30%的硝酸、溴水、氢氧化钠溶液 |
A. A B. B C. C D. D



