й«ҳдёӯ еҢ–еӯҰ

 B . Ka2(H2SeO3)зҡ„ж•°йҮҸзә§дёә10-7
C . ж··еҗҲжә¶ж¶Ідёӯ
B . Ka2(H2SeO3)зҡ„ж•°йҮҸзә§дёә10-7
C . ж··еҗҲжә¶ж¶Ідёӯ  =104
D . NaHSeO3жә¶ж¶Ідёӯc( H2SeO3)пјһc(
=104
D . NaHSeO3жә¶ж¶Ідёӯc( H2SeO3)пјһc(  )
)
дёҚеҗҢзҡ„жқЎд»¶пјҡ
в‘ еңЁ400в„ғж—¶пјҢ9molXдёҺ3molYеҸҚеә”
в‘ЎеңЁ400в„ғж—¶пјҢ15molXдёҺ5molYеҸҚеә”
в‘ўеңЁ300в„ғж—¶пјҢ9molXдёҺ3molYеҸҚеә”
йӮЈд№ҲпјҢеҸҚеә”ејҖе§Ӣж—¶пјҢжӯЈеҸҚеә”йҖҹзҺҮжңҖеӨ§зҡ„жҳҜ пјҺпјҲеЎ«еәҸеҸ·пјүпјҢжӯЈеҸҚеә”йҖҹзҺҮжңҖе°Ҹзҡ„жҳҜ
еҰӮеӣҫжҳҜз ”з©¶ж°Ҝж°”жҖ§иҙЁзҡ„иЈ…зҪ®еӣҫпјҢе…¶дёӯж°”дҪ“Mзҡ„дё»иҰҒжҲҗеҲҶжҳҜж°Ҝж°”пјҢжқӮиҙЁжҳҜж°ҜеҢ–ж°ўе’Ңж°ҙи’ёж°”пјҺеӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
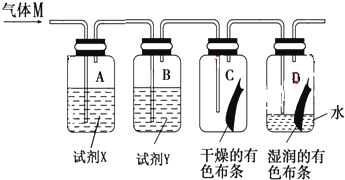
пјҲ1пјүиЈ…зҪ®AгҖҒBдёӯзҡ„иҜ•еүӮXе’ҢиҜ•еүӮYеҲҶеҲ«жҳҜ пјҲеЎ«еӯ—жҜҚд»ЈеҸ·пјүпјҺ
aпјҺNaOHжә¶ж¶І жө“зЎ«й…ё bпјҺNaClжә¶ж¶І жө“зЎ«й…ё cпјҺжө“зЎ«й…ё зҹізҒ°ж°ҙ
пјҲ2пјүиӢҘCдёӯжңүиүІеёғжқЎдёҚиӨӘиүІпјҢDдёӯжңүиүІеёғжқЎиӨӘиүІпјҺеҲҷе…·жңүжјӮзҷҪжҖ§зҡ„зү©иҙЁжҳҜ пјҲеЎ«зү©иҙЁеҗҚз§°пјүпјҢиҜҘе®һйӘҢиҜҒжҳҺж°Ҝж°”иғҪдёҺж°ҙеҸҚеә”пјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә пјҺ
пјҲ3пјүд»Һз»ҝиүІеҢ–еӯҰзҡ„и§’еәҰеҲҶжһҗпјҢдёҠиҝ°е®һйӘҢиЈ…зҪ®еӣҫдёӯеӯҳеңЁдёҖеӨ„зјәйҷ·пјҢж”№жӯЈзҡ„ж–№жі•жҳҜеҠ дёҖдёӘе°ҫж°”еӨ„зҗҶиЈ…зҪ®пјҢиҜҘе°ҫж°”еӨ„зҗҶиЈ…зҪ®еҶ…еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёәгҖҖ пјҺ
пјҲ4пјүе®һйӘҢе®ҢжҜ•еҗҺпјҢе°ҶDдёӯзҡ„ж°ҙжә¶ж¶ІпјҲе‘Ҳй»„з»ҝиүІпјүеҸ–еҮәпјҢеҲҶеҲ«еҠ е…ҘдёӨж”ҜиҜ•з®ЎдёӯпјҢиҝӣиЎҢеҰӮдёӢе®һйӘҢ
е®һйӘҢзј–еҸ· | ж»ҙеҠ зҡ„иҜ•еүӮ | е®һйӘҢзҺ°иұЎ | иҜҒжҳҺеӯҳеңЁзҡ„еҫ®зІ’ пјҲеЎ«еҫ®зІ’з¬ҰеҸ·пјү |
A | AgNO3 жә¶ж¶І | aпјҺ | bпјҺ |
B | зҙ«иүІзҹіи•Ҡжә¶ж¶І | cпјҺ | dпјҺгҖҖ |
| е®һйӘҢж“ҚдҪң | зҺ°иұЎ | з»“и®ә | |
| A | еҗ‘FeCl3жә¶ж¶ІдёӯеҠ е…Ҙжө“NaOHжә¶ж¶І | жә¶ж¶Із”ұй»„иүІеҸҳдёәзәўжЈ•иүІ | з”ҹжҲҗдәҶж°ўж°§еҢ–й“Ғиғ¶дҪ“ |
| B | еҗ‘Co2O3дёӯж»ҙе…Ҙжө“зӣҗй…ё | дә§з”ҹй»„з»ҝиүІж°”дҪ“ | ж°§еҢ–жҖ§:Cl2>Co2O3 |
| C | еҗ‘жҹҗжә¶ж¶Ідёӯж»ҙеҠ K3[Fe(CN)6]жә¶ж¶І | дә§з”ҹи“қиүІжІүж·Җ | жә¶ж¶ІдёӯеӯҳеңЁдәҡй“ҒзҰ»еӯҗ |
| D | еҗ‘NaHCO3жә¶ж¶Ідёӯж»ҙеҠ NaAlO2жә¶ж¶І | жңүзҷҪиүІжІүж·Җе’Ңж°”дҪ“дә§з”ҹ | AlO2-дёҺHCO3-еҸ‘з”ҹдәҶеҸҢж°ҙи§ЈеҸҚеә” |
 N
B . NaClOзҡ„з”өеӯҗејҸпјҡ
N
B . NaClOзҡ„з”өеӯҗејҸпјҡ
е®һйӘҢж“ҚдҪң | е®һйӘҢзҺ°иұЎ | и§ЈйҮҠжҲ–з»“и®ә | |
A | з”Ёеқ©еҹҡй’іеӨ№дҪҸе·Іиў«з Ӯзәёжү“зЈЁиҝҮзҡ„й“қз®”еңЁй…’зІҫзҒҜзҒ«з„°дёҠеҠ зғӯ | й“қдёҚиғҪж»ҙиҗҪдёӢжқҘ | й“қзҶ”зӮ№й«ҳпјҢжІЎиғҪзҶ”еҢ– |
B | е°ҶйҘұе’ҢFeCl3жә¶ж¶Іж»ҙе…Ҙз…®жІёзҡ„NaOHжә¶ж¶ІдёӯпјҢз”Ёе…үжқҹз…§е°„жүҖеҫ—ж¶ІдҪ“ | з”ҹжҲҗзәўиӨҗиүІйҖҸжҳҺж¶ІдҪ“пјҢз”Ёе…үжқҹз…§е°„ж—¶еҸҜи§ҒдёҖжқЎе…үдә®зҡ„йҖҡи·Ҝ | з”ҹжҲҗFeпјҲOHпјү3иғ¶дҪ“жңүдёҒиҫҫе°”ж•Ҳеә” |
C | з”Ёй“ӮдёқиҳёеҸ–жҹҗжә¶ж¶ІеңЁзҒ«з„°дёҠзҒјзғ§пјҢйҖҸиҝҮи“қиүІй’ҙзҺ»з’ғи§ӮеҜҹ | зҒ«з„°зҡ„йўңиүІдёәзҙ«иүІ | иҜҘжә¶ж¶Ідёӯеҗ«K+ пјҢ дёҚеҗ«Na+ |
D | еҸ–е°‘йҮҸжҹҗжә¶ж¶ІеҠ е…Ҙ2ж»ҙKSCNжә¶ж¶ІпјҢеҶҚеҠ е…ҘеҮ ж»ҙж°Ҝж°ҙ | ж»ҙеҠ KSCNжә¶ж¶Іж—¶жә¶ж¶ІдёҚеҸҳзәўпјҢж»ҙеҠ ж°Ҝж°ҙеҗҺжә¶ж¶ІеҸҳдёәзәўиүІ | иҜҘжә¶ж¶ІдёӯдёҚеҗ«Fe3+ пјҢ еҗ«жңүFe2+ |

-
пјҲ1пјү дёӢеҲ—жҺӘж–ҪдёӯпјҢжңүеҲ©дәҺйҷҚдҪҺеӨ§ж°”дёӯCO2жө“еәҰзҡ„жңүпјҡпјҺпјҲеЎ«еӯ—жҜҚпјү
aпјҺеҮҸе°‘еҢ–зҹізҮғж–ҷзҡ„дҪҝз”Ё
bпјҺжӨҚж ‘йҖ жһ—пјҢеўһеӨ§жӨҚиў«йқўз§Ҝ
cпјҺйҮҮз”ЁиҠӮиғҪжҠҖжңҜ
dпјҺеҲ©з”ЁеӨӘйҳіиғҪгҖҒйЈҺиғҪ
-
пјҲ2пјү е°ҶCO2иҪ¬еҢ–жҲҗжңүжңәзү©еҸҜжңүж•Ҳе®һзҺ°зўіеҫӘзҺҜпјҺCO2иҪ¬еҢ–жҲҗжңүжңәзү©зҡ„дҫӢеӯҗеҫҲеӨҡпјҢеҰӮпјҡ
a.6CO2+6H2O
 C6H12O6+6O2
C6H12O6+6O2bпјҺCO2+3H2
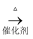 CH3OH+H2O
CH3OH+H2OcпјҺCO2+CH4
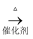 CH3COOH
CH3COOH d.2CO2+6H2
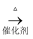 CH2в•җCH2+4H2O
CH2в•җCH2+4H2Oд»ҘдёҠеҸҚеә”дёӯпјҢжңҖиҠӮиғҪзҡ„жҳҜпјҢеҺҹеӯҗеҲ©з”ЁзҺҮжңҖй«ҳзҡ„жҳҜпјҺ
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„еҖјпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ
AпјҺ1 mol CH2пјқCH2еҲҶеӯҗдёӯеҗ«жңүзҡ„е…ұд»·й”®ж•°дёә6NA
BпјҺ500 mL 0.5 molВ·LвҲ’1зҡ„NaClжә¶ж¶Ідёӯеҫ®зІ’ж•°еӨ§дәҺ0.5NA
CпјҺ30 g HCHOдёҺCH3COOHж··еҗҲзү©дёӯеҗ«CеҺҹеӯҗж•°дёәNA
DпјҺ2.3 g NaдёҺO2е®Ңе…ЁеҸҚеә”пјҢеҸҚеә”дёӯиҪ¬з§»зҡ„з”өеӯҗж•°д»ӢдәҺ0.1NAе’Ң0.2NAд№Ӣй—ҙ
еҢ–еӯҰеҹәжң¬жҰӮеҝөгҖҒеҢ–еӯҰз”ЁиҜӯжҳҜдёӯеӯҰеҢ–еӯҰеӯҰд№ зҡ„йҮҚиҰҒеҶ…е®№д№ӢдёҖгҖӮ
Iпјҡж°§еҢ–иҝҳеҺҹеҸҚеә”е®һйҷ…дёҠеҢ…еҗ«ж°§еҢ–еҸҚеә”е’ҢиҝҳеҺҹеҸҚеә”дёӨдёӘиҝҮзЁӢпјҢдёҖдёӘиҝҳеҺҹеҸҚеә”иҝҮзЁӢзҡ„зҰ»еӯҗж–№зЁӢејҸдёәпјҡNO![]() +4H++3e
+4H++3e![]() ==NO+2H2OгҖӮ
==NO+2H2OгҖӮ
дёӢеҲ—еӣӣз§Қзү©иҙЁпјҡKMnO4пјҢNa2CO3пјҢNa2SO3пјҢFe2(SO4)3дёӯзҡ„дёҖз§Қзү©иҙЁз”ІпјҢж»ҙеҠ е°‘йҮҸзЁҖзЎқй…ёпјҢиғҪдҪҝдёҠиҝ°еҸҚеә”иҝҮзЁӢеҸ‘з”ҹгҖӮ
(1)иў«иҝҳеҺҹзҡ„е…ғзҙ жҳҜ___________пјӣиҝҳеҺҹеүӮжҳҜ_________гҖӮ
(2)еҶҷеҮә并й…Қе№іиҜҘж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ_________________гҖӮ
(3)иӢҘеҸҚеә”еҗҺпјҢиҝҳеҺҹдә§зү©зҡ„еҢ–еҗҲд»·йҷҚдҪҺпјҢиҖҢе…¶д»–зү©иҙЁд»·жҖҒдҝқжҢҒдёҚеҸҳпјҢеҲҷеҸҚеә”дёӯж°§еҢ–еүӮдёҺиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”е°Ҷ_______(еЎ«вҖңеўһеӨ§вҖқвҖңдёҚеҸҳвҖқеҮҸе°ҸвҖқжҲ–вҖңдёҚиғҪзЎ®е®ҡвҖқ)гҖӮ
IIпјҡе®һйӘҢе®ӨйңҖиҰҒз”ЁNa2CO3![]() l0H2Oй…ҚеҲ¶0.10molпјҸL Na2CO3жә¶ж¶І240mLгҖӮ
l0H2Oй…ҚеҲ¶0.10molпјҸL Na2CO3жә¶ж¶І240mLгҖӮ
жҢүдёӢеҲ—ж“ҚдҪңжӯҘйӘӨеЎ«дёҠйҖӮеҪ“зҡ„ж–Үеӯ—пјҢд»ҘдҪҝж•ҙдёӘж“ҚдҪңе®Ңж•ҙгҖӮ
(1)йҖүжӢ©д»ӘеҷЁгҖӮе®ҢжҲҗжң¬е®һйӘҢжүҖеҝ…йңҖзҡ„д»ӘеҷЁжңүпјҡжүҳзӣҳеӨ©е№і(зІҫзЎ®еҲ°0.1g)гҖҒиҚҜеҢҷгҖҒзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒ__________гҖҒ___________гҖӮ
(2)и®Ўз®—гҖӮ
(3)з§°йҮҸгҖӮй…ҚеҲ¶иҜҘжә¶ж¶ІйңҖз§°еҸ–Na2CO3![]() 10H2Oжҷ¶дҪ“_________gгҖӮ
10H2Oжҷ¶дҪ“_________gгҖӮ
 в‘ еӨ©е№іи°ғе№ід№ӢеҗҺпјҢеә”е°ҶеӨ©е№ізҡ„жёёз Ғи°ғиҮіжҹҗдёӘдҪҚзҪ®пјҢиҜ·еңЁдёӢеӣҫдёӯз”ЁдёҖж №з«–зәҝж ҮеҮәжёёз Ғе·Ұиҫ№зјҳжүҖеӨ„зҡ„дҪҚзҪ®пјҡ
в‘ еӨ©е№іи°ғе№ід№ӢеҗҺпјҢеә”е°ҶеӨ©е№ізҡ„жёёз Ғи°ғиҮіжҹҗдёӘдҪҚзҪ®пјҢиҜ·еңЁдёӢеӣҫдёӯз”ЁдёҖж №з«–зәҝж ҮеҮәжёёз Ғе·Ұиҫ№зјҳжүҖеӨ„зҡ„дҪҚзҪ®пјҡ
 в‘Ўз§°йҮҸиҝҮзЁӢдёӯNa2CO3
в‘Ўз§°йҮҸиҝҮзЁӢдёӯNa2CO3![]() 10H2Oжҷ¶дҪ“еә”ж”ҫдәҺеӨ©е№ізҡ„________(еЎ«вҖңе·ҰзӣҳвҖқжҲ–вҖңеҸізӣҳвҖқ)гҖӮ
10H2Oжҷ¶дҪ“еә”ж”ҫдәҺеӨ©е№ізҡ„________(еЎ«вҖңе·ҰзӣҳвҖқжҲ–вҖңеҸізӣҳвҖқ)гҖӮ
в‘ўз§°йҮҸе®ҢжҜ•пјҢе°ҶиҚҜе“ҒеҖ’е…Ҙзғ§жқҜдёӯгҖӮ
(4)жә¶и§ЈгҖҒеҶ·еҚҙпјҢиҜҘжӯҘе®һйӘҢдёӯйңҖиҰҒдҪҝз”ЁзҺ»з’ғжЈ’пјҢзӣ®зҡ„жҳҜ___________
(5)иҪ¬з§»гҖҒжҙ—ж¶ӨгҖӮВ (6)е®ҡе®№пјҢж‘ҮеҢҖгҖӮ
иӢҘи§ӮеҜҹе®ҡе®№ж—¶ж¶Ійқўжғ…еҶөеҰӮеҸіеӣҫжүҖзӨәпјҢжүҖй…Қжә¶ж¶Ізҡ„жө“еәҰдјҡ_________(еЎ«вҖңеҒҸй«ҳвҖқгҖҒвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ
е…ідәҺиғ¶дҪ“е’Ңжә¶ж¶Ізҡ„еҢәеҲ«пјҢдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
гҖҖAпјҺжә¶ж¶Іе‘Ҳз”өдёӯжҖ§пјҢиғ¶дҪ“еёҰжңүз”өиҚ·
гҖҖBпјҺжә¶ж¶Ідёӯжә¶иҙЁзІ’еӯҗиғҪйҖҡиҝҮж»ӨзәёпјҢиғ¶дҪ“дёӯеҲҶж•ЈиҙЁзІ’еӯҗдёҚиғҪйҖҡиҝҮж»Өзәё
гҖҖCпјҺжә¶ж¶ІдёӯйҖҡиҝҮдёҖжқҹе…үзәҝжІЎжңүзү№ж®ҠзҺ°иұЎпјҢиғ¶дҪ“дёӯйҖҡиҝҮдёҖжқҹе…үзәҝеҮәзҺ°жҳҺжҳҫе…үеёҰ
DпјҺжә¶ж¶ІзЁіе®ҡпјҢж”ҫзҪ®еҗҺдёҚдјҡз”ҹжҲҗжІүж·Җпјӣиғ¶дҪ“дёҚзЁіе®ҡпјҢж”ҫзҪ®дјҡз”ҹжҲҗжІүж·Җ
В (1)гҖҒNaHSO4еңЁжә¶ж¶Ідёӯзҡ„з”өзҰ»ж–№зЁӢејҸдёәпјҡВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В
В (2)гҖҒеҗ‘NaHSO4жә¶ж¶Ідёӯж»ҙе…ҘBa(OH)2жә¶ж¶ІиҮідёӯжҖ§пјҢе…¶зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В
В (3)гҖҒеҗ‘NaHCO3жә¶ж¶Ідёӯж»ҙеҠ иҝҮйҮҸзҡ„Ba(OH)2жә¶ж¶І пјҢе…¶зҰ»еӯҗж–№зЁӢејҸдёәВ В В В В В В В В В В В В В
дёӢеҲ—зү©иҙЁй—ҙзҡ„еҸҚеә”пјҢе…¶иғҪйҮҸеҸҳеҢ–з¬ҰеҗҲеҸіеӣҫзҡ„жҳҜ (гҖҖгҖҖ)
AпјҺй“қзғӯеҸҚеә”
BпјҺзҒјзғӯзҡ„зӮӯдёҺдәҢж°§еҢ–зўіеҸҚеә”
CпјҺBa(OH)2В·8H2Oжҷ¶дҪ“е’ҢNH4Clжҷ¶дҪ“ж··еҗҲ
DпјҺзўій…ёй’ҷзҡ„еҲҶи§Ј
жҹҗж··еҗҲж°”дҪ“еҸҜиғҪеҗ«COгҖҒCO2гҖҒNH3гҖҒHClгҖҒH2е’ҢH2OпјҲgпјүдёӯзҡ„дёҖз§ҚжҲ–еҮ з§ҚпјҢеҪ“дҫқж¬ЎйҖҡиҝҮжҫ„жё…зҹізҒ°ж°ҙпјҲж— жө‘жөҠзҺ°иұЎпјүгҖҒж°ўж°§еҢ–й’Ўжә¶ж¶ІпјҲжңүжө‘жөҠзҺ°иұЎпјүгҖҒжө“зЎ«й…ёпјҲеўһйҮҚпјүгҖҒзҒјзғӯж°§еҢ–й“ңпјҲеҸҳзәўпјүе’Ңж— ж°ҙзЎ«й…ёй“ңпјҲеҸҳи“қпјүж—¶пјҢдёӢеҲ—еҜ№еҺҹж··еҗҲж°”дҪ“жҲҗеҲҶзҡ„жҺЁж–ӯдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү
AпјҺдёҖе®ҡжңүCO2гҖҒHClгҖҒH2 BпјҺеҸҜиғҪжңүCOгҖҒH2O
CпјҺдёҖе®ҡжІЎжңүNH3гҖҒCO2В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В DпјҺдёҖе®ҡжІЎжңүNH3гҖҒеҸҜиғҪжңүCO
иғҪеңЁж°ҙжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ(гҖҖгҖҖ)
AпјҺHпјӢгҖҒFe3пјӢгҖҒSO![]() гҖҒIпјҚ
гҖҒIпјҚ
BпјҺHпјӢгҖҒNH![]() гҖҒHCO
гҖҒHCO![]() гҖҒNO
гҖҒNO![]()
CпјҺAgпјӢгҖҒKпјӢгҖҒClпјҚгҖҒSO![]()
DпјҺKпјӢгҖҒAlO![]() гҖҒClпјҚгҖҒOHпјҚ
гҖҒClпјҚгҖҒOHпјҚ

жұҪиҪҰе°ҫж°”дёӯNOдә§з”ҹзҡ„еҸҚеә”дёәN2(g)пјӢO2(g)![]() 2NO(g),дёҖе®ҡжқЎд»¶дёӢ,зӯүзү©иҙЁзҡ„йҮҸзҡ„N2(g)е’ҢO2(g)еңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸҚеә”,еҰӮеӣҫжӣІзәҝaиЎЁзӨәиҜҘеҸҚеә”еңЁжё©еәҰTдёӢN2зҡ„жө“еәҰйҡҸж—¶й—ҙзҡ„еҸҳеҢ–,жӣІзәҝbиЎЁзӨәиҜҘеҸҚеә”еңЁжҹҗдёҖиө·е§ӢеҸҚеә”жқЎд»¶ж”№еҸҳж—¶N2зҡ„жө“еәҰйҡҸж—¶й—ҙзҡ„еҸҳеҢ–гҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
2NO(g),дёҖе®ҡжқЎд»¶дёӢ,зӯүзү©иҙЁзҡ„йҮҸзҡ„N2(g)е’ҢO2(g)еңЁжҒ’е®№еҜҶй—ӯе®№еҷЁдёӯеҸҚеә”,еҰӮеӣҫжӣІзәҝaиЎЁзӨәиҜҘеҸҚеә”еңЁжё©еәҰTдёӢN2зҡ„жө“еәҰйҡҸж—¶й—ҙзҡ„еҸҳеҢ–,жӣІзәҝbиЎЁзӨәиҜҘеҸҚеә”еңЁжҹҗдёҖиө·е§ӢеҸҚеә”жқЎд»¶ж”№еҸҳж—¶N2зҡ„жө“еәҰйҡҸж—¶й—ҙзҡ„еҸҳеҢ–гҖӮдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ
В В В AпјҺжӣІзәҝbеҜ№еә”зҡ„жқЎд»¶ж”№еҸҳеҸҜиғҪжҳҜеҠ е…ҘдәҶеӮ¬еҢ–еүӮ
В В В BпјҺжё©еәҰTдёӢ,йҡҸзқҖеҸҚеә”зҡ„иҝӣиЎҢ,ж··еҗҲ![]() ж°”дҪ“зҡ„еҜҶеәҰеҮҸе°Ҹ
ж°”дҪ“зҡ„еҜҶеәҰеҮҸе°Ҹ
В В В CпјҺжё©еәҰTдёӢ,иҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°K=![]()
В В В DпјҺиӢҘжӣІзәҝbеҜ№еә”зҡ„жқЎд»¶![]() ж”№еҸҳжҳҜжё©еәҰ,еҸҜеҲӨж–ӯиҜҘеҸҚеә”зҡ„О”H<0
ж”№еҸҳжҳҜжё©еәҰ,еҸҜеҲӨж–ӯиҜҘеҸҚеә”зҡ„О”H<0
жҹҗй“ҫзҠ¶жңүжңәзү©еҲҶеӯҗдёӯеҗ«mдёӘпјҚCH3пјҢnдёӘпјҚCH2пјҚпјҢ aдёӘ![]() е…¶дҪҷдёәпјҚOHпјҢеҲҷзҫҹеҹәзҡ„ж•°зӣ®еҸҜиғҪжҳҜ
е…¶дҪҷдёәпјҚOHпјҢеҲҷзҫҹеҹәзҡ„ж•°зӣ®еҸҜиғҪжҳҜ
AпјҺaпјӢ2пјҚmВ В В В BпјҺ2nпјӢ3aпјҚmВ В В В В CпјҺnпјӢmпјӢaВ В В В В DпјҺaпјӢ2nпјӢ2пјҚm



