高三化学试题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.密闭容器中2molNO与1molO2充分反应后,容器内气体的分子数为2NA
B.用惰性电极电解CuSO4溶液后,如果加入0.1molCu(OH)2能使溶液复原,则电路中转移电子的数目为0.2NA
C.142 g Na2SO4和Na2HPO4固体混合物中,阴阳离子总数为3NA
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.4NA
SO2是一种大气污染物,某兴趣小组欲探究SO2的性质及绿色实验方法,设计如下方案:
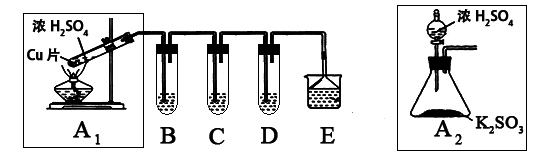
⑴ B、C、D分别用于检验SO2的漂白性、还原性和氧化性。其中C、D分别为碘水和硫化氢的水溶液,则B中所盛试剂为______________,C中反应的离子方程式为:____________________________________________。
⑵ 为了实现绿色实验的目标,某同学重新设计了如上右图A2的制取装置来代替A1装置,与A1装置相比,A2装置的优点是:_____________________________(任写一点即可)。
⑶ E中用氨水吸收尾气中的SO2,“吸收液”中可能含有OH-、SO32-、SO42-、HSO3-等阴离子。已知亚硫酸氢盐一般易溶于水,SO2也易溶于水。现有仪器和试剂为:小烧杯、试管、玻璃棒、胶头滴管、过滤装置和滤纸;2mol/L盐酸、2mol/L HNO3、1mol/L BaCl2溶液、1mol/L Ba(OH)2溶液、品红溶液、蒸馏水。请设计实验证明“吸收液”中存在SO32-和HSO3-,完成下表的实验操作、预期现象和结论:
| 实验操作 | 预期现象与结论 |
| 步骤1:取适量“吸收液”于小烧杯中,用胶头滴管取1mol/L BaCl2溶液向小烧杯滴加直至过量。 | 若出现白色浑浊,则溶液中存在SO32-或 SO42-。 |
| 步骤2:将小烧杯中的浊液过滤、洗涤,再用适量水把附在滤纸上的固体冲入另一小烧杯中;向冲下的固体_______________ _______________________________________________________ | _________________________ ____________________________ |
| 步骤3______________________________________________ ____________________________________________________ | _________________________ _________________________ |
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列说法正确的是
A.原子半径的大小顺序: r(Y)>r(Z)>r(W) B.元素Z、W 的简单离子的电子层结构不同
C.元素Y 的简单气态氢化物的热稳定性比Z 的强
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g • cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol • L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A.该浓硝酸中的HNO3的物质的量浓度是14.0 mol • L-1
B.加入NaOH溶液的体积是50 mL
C.浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D.得到的金属氢氧化物的沉淀为3.12 g
.向物质的量浓度均为1mol/L的Fe2(SO4)3、CuSO4的1L混合液中加入a mol铁粉,充分反应后,下列说法正确的是 ( )
A. 当a≤1时,发生的反![]() 应为Fe+Cu2+=Fe2++Cu
应为Fe+Cu2+=Fe2++Cu
B. 当固体有剩余时,溶液中一定存在Fe2+、Cu2+
C. 当1≤a<2时,溶液中 n(Fe2+)=(2+a)mol
D. 若有固体剩余,则固体中一定有铁,可能有铜
同温同压下,对于等体积的一氧化氮(14N18O)和一氧化碳(13C18O)气体,下列说法正确的是: ( )
A.含相同的分子数和原子数 B.含相同的分子数和电子数
C.含相同的质子数和中子数 D.所含分子数和质量均不相同
.短周期主族元素W、X、Y、Z的原子序数依次增大,W的简单氢化物可用作制冷剂,
Y的原子半径是所有短周期主族元素中最大的。由X、Y和Z三种元素形成的一种盐
溶于水后,加入稀盐酸,有黄色沉淀析出,同时有刺激性气体产生。下列说法不正确
的是
A.X的简单氢化物的热稳定性比W强
B.Y的简单离子与X的具有相同的电子层结构
C.Y与Z形成化合物的水溶液可使蓝色石蕊试纸变红
D.Z与X属于同一主族,与Y属于同一周期
W、X、Y、Z是原子序数依次增大的同一短周期元素,W是金属元素,X是地壳中含量最多的金属元素,且W、X的最高价氧化物的水化物相互反应生成盐和水;Y、Z是非金属元素,Y与W可形成离子化合物W2Y;G在Y的前一周期,其原子最外层比Y原子最外层少一个电子.
(1)X的原子结构示意图为 ;
(2)W、X的最高价氧化物的水化物相互反应的离子方程式为 ;
(3)工业上制取X单质的化学方程式为 ;
(4)G的气态氢化物与Y的最高价氧化物的水化物恰好反应生成的正盐溶液中,离子浓度由大到小的顺序为 ;在催化剂作用下,汽车尾气中G的氧化物GO与CO两种气体能相互反应转化为无污染、能参与大气循环的两种气体,若有33.6L(已换算成标准状况)一氧化碳参加反应,转移的电子数为 mol;
(5)298K时,Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到Z的最高价氧化物的水化物的稀溶液,并放出a kJ的热量,该反应的热化学方程式为 .
某同学用Na2CO3和NaHCO3溶液进行如图所示实验。下列说法中不正确的是( )
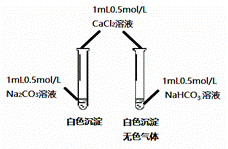
A.实验前pH(Na2CO3)>pH(NaHCO3)
B.实验后两溶液中离子种类完全相同
C.Na2CO3溶液中生成的沉淀比NaHCO3溶液中生成的沉淀多
D.两溶液中反应的基本类型相同
已知甲醛(HCHO)分子中的4个原子是共平面的。下列分子中所有原子不可能同时存在于同一个平面上是( )
A.苯乙烯 ![]() B.苯甲醛
B.苯甲醛 ![]()
C.苯乙酮 D.苯酚
D.苯酚 ![]()
下列各组物质中,物![]() 质之间通过一步反应就能实现图示变化的是
质之间通过一步反应就能实现图示变化的是
| 物质编号 | 物质转化关系 | a | b | c | d |
| ① |
| FeCl2 | FeC13 | Fe | CuCl2 |
| ② | NO | NO2 | N2 | HNO3 | |
| ③ | Na2O | Na2O2 | Na | NaOH | |
| ④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①④ B.①②③ C.①③④ D.②④
乙酸乙酯能在多种条件下发生水解反应:
CH3COOC2H5+H2O![]() CH3COOH+C2H5OH。
CH3COOH+C2H5OH。
已知该反应的速率随c(H+)的增大而加快。下图为CH3COOC2H5的水解速率随时间的变化如图。下列说法中正确的是( )

A.反应初期水解速率增大可能是溶液中c(H+)增大所致
B.A、B两点表示的c(CH3COOC2H5)相等
C.图中t 0时反应达到平衡状态
D.t 0时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
在限定条件下,下列溶液中各组离子一定能大量共存的是( )
A.使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3﹣、Cl﹣
B.与Al能产生氢气的溶液:K+、SO42﹣、CO32﹣、NH4+
C.碳酸氢钠溶液:K+、SO42﹣、Cl﹣、H+
D.pH<7的溶液:K+、Na+、Cl﹣、SO42﹣
设NA表示阿伏加德罗常数,下列说法正确的是( )
A.1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B.标准状况下,以任意比混合的氢气和一氧化碳气体共8.96L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
C.含1 mol FeCl3的溶液中Fe3+的个数为NA D.1.8 g NH4+中含有的电子数为0.1NA
目前,科学界拟合成一种“双重结构”的球形分子,即把足球烯C60的分子容纳在Si60分子中,外面的硅原子与里面的碳原子以共价键结合,下列叙说不正确的是( )
A.该反应为置换反应
B.该晶体为分子晶体
C.该物质是一种新的化合物
D.该物质的相对分子质量是2400
下列关于物质或离子检验的推断正确的是
A. 向X溶液中滴加KSCN溶液,溶液显红色,证明X溶液中有Fe3+,无Fe2+
B. 用硝酸酸化Y溶液,无现象,再加入硝酸钡溶液,产生白色沉淀,则Y溶液中含有SO42-
C. 用玻璃棒蘸Z溶液在酒精灯上灼烧,火焰呈黄色,再透过钴玻璃观察火焰无紫色,则Z溶液中有Na+,无K+
D. 用盐酸酸化W溶液,无现象,再向其中滴加AgNO3溶液,产生白色沉淀,则W溶液中含有Cl-
按照要求,回答下列问题
(1)写出下列物质熔融态的电离方程式:NaHSO4 。
(2)将粗盐溶解过滤除去不溶性杂质后,在滤液中依次滴加过量NaOH溶液、BaCl2溶液和Na2CO3溶液,直至不再产生沉淀。滴加Na2CO3溶液时发生反应的化学方程式为 。
(3)写出制备Fe(OH)3胶体的化学方程式:__________ __。取乙烧杯中少量Fe(OH)3胶体置于试管中,向试管中逐渐滴加稀盐酸至过量,发生此变化的离子方程式为___________ ____。
某化学反应2X(g)=Y(g)+Z(s)的能量变化如图所示。下列说法正确的是( )

A.引发该反应一定需要加热或点燃等条件 B.E1逆反应的活化能,E2是正反应的活化能
C.催化剂能减小E1和E2,但不改变反应的焓变 D.X、Y、Z表示的反应速率之比为2∶1∶1
[化学——物质结构与性质](1 5分)
四种短周期元素A、13、C、D的原子序数依次递增.其中A、B、C二种元素基态原子的2p能级上都有未成对电子.且术成对电子个数分别是2、3、2;D与C 可以形成D2C和D2C2两种化合物。回答下列问题:
(1)已知A元素与氢元素形成的某种气态化合物在标准状况下的密度为1.1 6 1 g·L-1,则在该化合物的分子中A原子的杂化方式为 。
(2)A、B、C二种元素的第一电离能由小到大的顺序为 (填元素符号)。
 (3)+1价气态基态阳离子再欠去一个电子形成+2价气态基态阳离子所需
(3)+1价气态基态阳离子再欠去一个电子形成+2价气态基态阳离子所需
要的能量称为第二电离能I2,依次还有I3、I4、I5……,推测D元素的电
离能第一次突增应出现在第电离能。
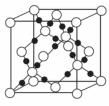
(4)AC2在高温高压下所形成的晶体其晶胞如图所示。该晶体的类型属于 晶
体.该品体中A原子轨道的杂化类型为 。
 (5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间
(5)C和C形成原子个数比为1:3的常见离子.推测这两种微粒的空间
构型为 。
(6)C和D形成的一种离子化合物D2C的品胞结构如图所示.该晶体中阳
离子的配位数为 。距一个阴离子周围最近的所有阳离子为顶点构成
的几何体为 。
已知该晶胞的密度为ρg·cm-3,阿伏加德罗常数为NA.则晶胞边长a= cm(用含ρ、NA的代数式表示)。
实验室常利用甲醛法测定某(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO = 4H+ +(CH2)6N4+6H2O,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤① 用电子天平准确称取样品1.5000 g。
步骤② 将样品溶解并冷却后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤③ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛,摇匀、静置5min,加入2滴酚酞试液,用NaOH标准溶液滴定到终点。重复步骤③操作2次。
(1)根据步骤③填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积将
(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变为 色,半分钟内不退色。
⑤滴定后俯视读数,测得样品中氮的质量分数将 (填“偏高”、“偏低”或“无影响”)。
(2)滴定结果如下表所示:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
若NaOH标准溶液的浓度为0.1000 mol·L-1,则该样品中氮的质量分数为 。(保留两位小数)




