й«ҳдёүеҢ–еӯҰпјҡ дёҠеӯҰжңҹдёҠеҶҢгҖҖгҖҖдёӢеӯҰжңҹдёӢеҶҢ
й«ҳдёүеҢ–еӯҰиҜ•йўҳ
дёӢеҲ—зү©иҙЁзҡ„жә¶ж¶ІпјҢиғҪе’Ңе°ҸиӢҸжү“еҸҚеә”пјҢдё”ж—ўж— ж°”дҪ“д№ҹж— жІүж·Җдә§з”ҹзҡ„жҳҜ
В В AпјҺиӢҸжү“В В В В В В В В В В В В BпјҺж°ҜеҢ–ж°ўВ В В В В В В В В CпјҺзҶҹзҹізҒ°В В В В В В В В В DпјҺзғ§зўұ
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗдёҖе®ҡиғҪеңЁжҢҮе®ҡжә¶ж¶ІдёӯеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ (В В В )
AпјҺ1.0molВ·L-1зҡ„KNO3жә¶ж¶ІдёӯпјҡFe2пјӢгҖҒH+гҖҒCl-гҖҒI-
BпјҺеёёжё©дёӢпјҢеңЁc(H+)/c(OHпјҚ) = 1Г—1012зҡ„жә¶ж¶ІпјҡNH4+гҖҒMg2+гҖҒC1пјҚгҖҒK+
CпјҺеҗ«еӨ§йҮҸFe3+зҡ„жә¶ж¶ІдёӯпјҡNa+гҖҒMg2+гҖҒSO42-гҖҒSCN-
DпјҺж°ҙз”өзҰ»зҡ„c(HпјӢ)пјқ1Г—10пјҚ13 molВ·LпјҚ1зҡ„жә¶ж¶ІдёӯпјҡKпјӢгҖҒNaпјӢгҖҒAlO2пјҚгҖҒCO32пјҚ
жҹҗжә¶ж¶Іеҗ«жңүдә”з§ҚзҰ»еӯҗпјҢдё”еҗ„зҰ»еӯҗзү©иҙЁзҡ„йҮҸжө“еәҰзӣёзӯү(дёҚиҖғиҷ‘ж°ҙи§ЈдёҺз”өзҰ»)пјҢе·ІзҹҘе…¶дёӯдёүз§ҚзҰ»еӯҗдёәNa+гҖҒIвҖ”гҖҒNO3вҖ”пјҢеҲҷеҸҰеӨ–дёӨз§ҚзҰ»еӯҗеҸҜиғҪжҳҜ
A. Ba2+е’ҢOHвҖ”В В В B. K+е’ҢAlO2вҖ”В В В C. Fe3+е’ҢSO42вҖ”В В В D. H+е’ҢClвҖ”
AгҖҒBгҖҒDгҖҒEгҖҒFдёәзҹӯе‘Ёжңҹе…ғзҙ пјҢйқһйҮ‘еұһе…ғзҙ AжңҖеӨ–еұӮз”өеӯҗж•°дёҺе…¶е‘Ёжңҹж•°зӣёеҗҢпјҢBзҡ„жңҖеӨ–еұӮз”өеӯҗж•°жҳҜе…¶жүҖеңЁе‘Ёжңҹж•°зҡ„2еҖҚгҖӮBеңЁDдёӯе……еҲҶзҮғзғ§иғҪз”ҹжҲҗе…¶жңҖй«ҳд»·еҢ–еҗҲзү©BD2гҖӮEпјӢдёҺD2пјҚе…·жңүзӣёеҗҢзҡ„з”өеӯҗж•°гҖӮAеңЁFдёӯзҮғзғ§пјҢдә§зү©жә¶дәҺж°ҙеҫ—еҲ°дёҖз§Қејәй…ёгҖӮ
пјҲ1пјүAеңЁе‘ЁжңҹиЎЁдҪҚзҪ®________еҶҷеҮәдёҖз§Қе·ҘдёҡеҲ¶еӨҮеҚ•иҙЁFзҡ„зҰ»еӯҗж–№зЁӢејҸпјҡ___________________гҖӮ
пјҲ2пјүBгҖҒDгҖҒEз»„жҲҗзҡ„дёҖз§ҚзӣҗдёӯпјҢEзҡ„иҙЁйҮҸеҲҶж•°дёә43%пјҢе…¶дҝ—еҗҚдёә_______е…¶ж°ҙжә¶ж¶ІдёҺFеҚ•иҙЁеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә__________________________________.
пјҲ3пјүз”ұиҝҷдәӣе…ғзҙ з»„жҲҗзҡ„зү©иҙЁпјҢе…¶з»„жҲҗе’Ңз»“жһ„дҝЎжҒҜеҰӮдёӢиЎЁпјҡ
| зү©иҙЁ | з»„жҲҗе’Ңз»“жһ„дҝЎжҒҜ |
| a | еҗ«жңүAзҡ„дәҢе…ғзҰ»еӯҗеҢ–еҗҲзү© |
| b | еҗ«жңүйқһжһҒжҖ§е…ұд»·й”®зҡ„дәҢе…ғзҰ»еӯҗеҢ–еҗҲзү©пјҢдё”еҺҹеӯҗж•°д№ӢжҜ”дёә1вҲ¶1 |
| c | еҢ–еӯҰз»„жҲҗдёәBDF2 |
| d | еҸӘеӯҳеңЁдёҖз§Қзұ»еһӢдҪңз”ЁеҠӣдё”еҸҜеҜјз”өзҡ„еҚ•иҙЁжҷ¶дҪ“ |
aзҡ„еҢ–еӯҰејҸдёә________пјӣbзҡ„еҢ–еӯҰејҸдёә______________пјӣ
cзҡ„з”өеӯҗејҸдёә________, dжҳҜ________жҷ¶дҪ“
пјҲ4пјүз”ұAе’ҢBе…ғзҙ з»„жҲҗзҡ„дәҢе…ғеҢ–еҗҲзү©жҳҜ жІјж°”зҡ„дё»иҰҒжҲҗеҲҶпјҢе…¶дёҺж°§ж°”еңЁй…ёжҖ§з”өи§ЈиҙЁжә¶ж¶Ідёӯз»„жҲҗзҮғж–ҷз”өжұ ж¶ҲиҖ—ж ҮеҶөдёӢ11.2Lж°§ж°”ж—¶иҪ¬з§»з”өеӯҗж•°дёә__________molгҖӮ
|

зӣҙжҺҘз”өи§Јеҗёж”¶жҳҜзғҹж°”и„ұзЎқзҡ„дёҖз§Қжңүж•Ҳж–№жі•гҖӮз”Ё6%зҡ„зЁҖзЎқй…ёеҗёж”¶NOxдјҡз”ҹжҲҗдәҡзЎқй…ёпјҢеҶҚе°Ҷеҗёж”¶ж¶ІеҜје…Ҙ
з”өи§Јж§ҪдҪҝд№ӢиҪ¬еҢ–дёәзЎқй…ёгҖӮз”өи§ЈиЈ…зҪ®еҰӮдёӢ(йҳҙгҖҒйҳізҰ»еӯҗеҸҜйҖҡиҝҮйҡ”иҶңпјҢдҪҶеҲҶеӯҗдёҚиғҪйҖҡиҝҮ)пјҡдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
AпјҺеҗёж”¶NOxзҡ„иҝҮзЁӢж¶үеҸҠж°§еҢ–иҝҳеҺҹеҸҚеә”
BпјҺзҹіеўЁз”өжһҒдёәйў—зІ’зҠ¶пјҢеҸҜеўһеӨ§жҺҘи§Ұйқўз§ҜпјҢжҸҗй«ҳз”өи§Јж•ҲзҺҮ
CпјҺеҪ“bжһҒдёҠдә§з”ҹ2.8 L(ж ҮеҮҶзҠ¶еҶө)H2ж—¶пјҢиҪ¬з§»зҡ„з”өеӯҗж•°дёә0.5NA(и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖј)
DпјҺaжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәHNO2пјҚ2eпјҚпјӢH2O===3HпјӢпјӢNO![]()
NAиЎЁзӨәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜВ В В В В В В пјҲгҖҖ пјү
В В В AпјҺ1 molВ·LпјҚ1 зӣҗй…ёдёӯеҗ«жңүзҡ„ж°ҜеҢ–ж°ўеҲҶеӯҗж•°дёәNA
В В В BпјҺж ҮеҮҶзҠ¶еҶөдёӢпјҢ22.4Lзҡ„SO2ж°”дҪ“дёӯеҗ«жңүзҡ„ж°§еҺҹеӯҗж•°дёә2NA
В В В CпјҺ1L1.0 molВ·LпјҚ1CH3COOHжә¶ж¶Ідёӯеҗ«жңүзҡ„HпјӢж•°дёҖе®ҡдёәNA
DпјҺ2.7g AlеңЁдёҺи¶ійҮҸзӣҗй…ёеҸҚеә”дёӯеӨұз”өеӯҗж•°дёә0.3NA
е·ІзҹҘпјҡ(HF)2(g) ![]() 2HF(g)В в–іH>0пјҢе№іиЎЎдҪ“зі»зҡ„жҖ»иҙЁйҮҸm(жҖ»)дёҺжҖ»зү©иҙЁзҡ„йҮҸn(жҖ»)д№ӢжҜ”еңЁдёҚеҗҢжё©еәҰдёӢйҡҸеҺӢејәзҡ„еҸҳеҢ–жӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
2HF(g)В в–іH>0пјҢе№іиЎЎдҪ“зі»зҡ„жҖ»иҙЁйҮҸm(жҖ»)дёҺжҖ»зү©иҙЁзҡ„йҮҸn(жҖ»)д№ӢжҜ”еңЁдёҚеҗҢжё©еәҰдёӢйҡҸеҺӢејәзҡ„еҸҳеҢ–жӣІзәҝеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺжё©еәҰпјҡT1< T2
BпјҺе№іиЎЎеёёж•°пјҡK(a)=K(b)<K(c)
CпјҺеҸҚеә”йҖҹзҺҮпјҡv(b)>v(a)
DпјҺеҪ“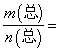 30gВ·mol-1ж—¶пјҢn(HF)пјҡn[(HF)2]=2:1
30gВ·mol-1ж—¶пјҢn(HF)пјҡn[(HF)2]=2:1
пјҺеҗ‘зӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„Ba(OH)2 дёҺBaCl2 зҡ„ж··еҗҲжә¶ж¶ІдёӯеҠ е…ҘNaHCO3 жә¶ж¶ІпјҢдёӢеҲ—зҰ»еӯҗж–№зЁӢејҸдёҺдәӢе®һзӣёз¬Ұзҡ„жҳҜпјҲВ В В пјү
AпјҺHCO3-+OH- =CO32-+H2OВ В В В В В В В В BпјҺBa2++OH-+HCO3-=BaCO3вҶ“+H2O
CпјҺBa2++2OH-+2HCO3-=BaCO3вҶ“+CO32-+H2O
DпјҺ2Ba2++3OH-+3HCO3-=2BaCO3вҶ“+CO32-+3H2O
дёӢеҲ—дёүдёӘеҢ–еӯҰеҸҚеә”зҡ„е№іиЎЎеёёж•°пјҲK1гҖҒK2гҖҒK3пјүдёҺжё©еәҰзҡ„е…ізі»еҲҶеҲ«еҰӮдёӢиЎЁжүҖзӨәпјҡ
| еҢ–еӯҰеҸҚеә” | е№іиЎЎеёёж•° | жё©еәҰ | |
| 973K | 1173K | ||
| в‘ Fe(s) + CO2(g) | K1 | 1.47 | 2.15 |
| в‘Ў Fe(s) + H2O(g) | K2 | 2.38 | 1.67 |
| в‘ў CO(g) + H2O(g) | K3 | пјҹ | пјҹ |
еҲҷдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
AпјҺО”H 1пјң0пјҢО”H 2пјһ0
BпјҺеҸҚеә”в‘ в‘Ўв‘ўзҡ„еҸҚеә”зғӯж»Ўи¶іе…ізі»пјҡО”H 2пјҚО”H 1пјқО”H 3
CпјҺеҸҚеә”в‘ в‘Ўв‘ўзҡ„е№іиЎЎеёёж•°ж»Ўи¶іе…ізі»пјҡK1В·K2пјқK3
DпјҺиҰҒдҪҝеҸҚеә”в‘ўеңЁдёҖе®ҡжқЎд»¶дёӢе»әз«Ӣзҡ„е№іиЎЎеҗ‘жӯЈеҸҚеә”ж–№еҗ‘移еҠЁпјҢеҸҜйҮҮеҸ–еҚҮжё©жҺӘж–Ҫ
дәҡзЎқй…°зЎ«й…ё![]() дё»иҰҒз”ЁдәҺеҲҶж•Јжҹ“ж–ҷйҮҚж°®еҸҚеә”дёӯеҸ–д»ЈдәҡзЎқй…ёй’ пјҢд»ҺиҖҢйҷҚдҪҺжҲҗжң¬пјҢжҸҗй«ҳдә§е“ҒиҙЁйҮҸгҖӮе®һйӘҢе®Өз”ЁеҰӮеӣҫиЈ…зҪ®пјҲеӨ№жҢҒиЈ…зҪ®з•ҘпјүеҲ¶еӨҮе°‘йҮҸNOSO4HпјҢ并жөӢе®ҡдә§е“Ғзҡ„зәҜеәҰгҖӮе·ІзҹҘпјҡNOSO4HйҒҮж°ҙеҲҶи§ЈпјҢдҪҶжә¶дәҺжө“зЎ«й…ёиҖҢдёҚеҲҶи§ЈгҖӮ
дё»иҰҒз”ЁдәҺеҲҶж•Јжҹ“ж–ҷйҮҚж°®еҸҚеә”дёӯеҸ–д»ЈдәҡзЎқй…ёй’ пјҢд»ҺиҖҢйҷҚдҪҺжҲҗжң¬пјҢжҸҗй«ҳдә§е“ҒиҙЁйҮҸгҖӮе®һйӘҢе®Өз”ЁеҰӮеӣҫиЈ…зҪ®пјҲеӨ№жҢҒиЈ…зҪ®з•ҘпјүеҲ¶еӨҮе°‘йҮҸNOSO4HпјҢ并жөӢе®ҡдә§е“Ғзҡ„зәҜеәҰгҖӮе·ІзҹҘпјҡNOSO4HйҒҮж°ҙеҲҶи§ЈпјҢдҪҶжә¶дәҺжө“зЎ«й…ёиҖҢдёҚеҲҶи§ЈгҖӮ

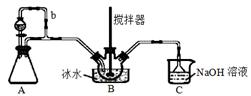
пјҲ1пјүиЈ…зҪ®AеҲ¶еҸ–SO2пјҢеҲҷAдёӯеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В пјҢВ еҜјз®Ўbзҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
пјҲ2пјүSO2дёҺиЈ…зҪ®Bдёӯзӣӣжңүзҡ„жө“зЎ«й…ёе’Ңжө“зЎқй…ёзҡ„ж··еҗҲж¶ІеңЁз»ҙжҢҒдҪ“зі»жё©еәҰдёҚеҫ—й«ҳдәҺ20в„ғзҡ„жқЎд»¶дёӢпјҢеҸҚеә”еҲ¶еҫ—NOSO4HгҖӮеҸҚеә”иҝҮзЁӢдёӯпјҢдәҡзЎқй…°зЎ«й…ёе’ҢзЎқй…ёзҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙзҡ„еҸҳеҢ–еҰӮеӣҫжүҖзӨәгҖӮеҸҚеә”иҝӣиЎҢеҲ°10minеҗҺпјҢеҸҚеә”йҖҹеәҰжҳҺжҳҫеҠ еҝ«пјҢе…¶еҸҜиғҪзҡ„еҺҹеӣ жҳҜ_________________гҖӮ
пјҲ3пјүиЈ…зҪ®Cзҡ„дё»иҰҒдҪңз”ЁжҳҜ____________гҖӮ
пјҲ4пјүиҜҘе®һйӘҢиЈ…зҪ®еӯҳеңЁеҸҜиғҪеҜјиҮҙNOSO4Hдә§йҮҸйҷҚдҪҺзҡ„зјәйҷ·жҳҜ____________________гҖӮ
пјҲ5пјүжөӢе®ҡдәҡзЎқй…°зЎ«й…ёNOSO4Hзҡ„зәҜеәҰ
еҮҶзЎ®з§°еҸ–1.500gдә§е“Ғж”ҫе…Ҙ250mLзҡ„зўҳйҮҸ瓶дёӯпјҢеҠ е…Ҙ0.1000molВ·LдёҖ1гҖҒ60.00mLзҡ„KMnO4ж ҮеҮҶжә¶ж¶Іе’Ң10mL25%H2SO4жә¶ж¶ІпјҢ然еҗҺж‘ҮеҢҖгҖӮз”Ё0.2500molВ·L-1иҚүй…ёй’ ж ҮеҮҶжә¶ж¶Іж»ҙе®ҡпјҢж¶ҲиҖ—иҚүй…ёй’ жә¶ж¶Ізҡ„дҪ“з§Ҝдёә20.00mLгҖӮ
е·ІзҹҘпјҡ2KMnO4+5NOSO4H+2H2O=K2SO4+2MnSO4+5HNO3+2H2SO4
2MnO4дёҖ+5C2O42дёҖ+16H+=2Mn2++10CO2вҶ‘+8H2O
иҫҫеҲ°ж»ҙе®ҡз»ҲзӮ№ж—¶зҡ„зҺ°иұЎдёә__________пјҢдәҡзЎқй…°зЎ«й…ёзҡ„зәҜеәҰдёә_________гҖӮ
йүҙеҲ«иӢҜй…ҡжә¶ж¶ІгҖҒе·ұзғ·гҖҒе·ұзғҜгҖҒд№ҷйҶӣжә¶ж¶Іе’Ңд№ҷйҶҮж¶ІдҪ“пјҢеҸҜйҖүз”Ёзҡ„жңҖдҪіиҜ•еүӮжҳҜ
AпјҺзҹіи•ҠиҜ•ж¶ІгҖҒжәҙж°ҙ
BпјҺжәҙж°ҙгҖҒж–°еҲ¶зҡ„Cu(OH)2
CпјҺFeCl3жә¶ж¶ІгҖҒйҮ‘еұһй’ гҖҒжәҙж°ҙгҖҒзҹіи•ҠиҜ•ж¶ІВ В В
DпјҺKMnO4й…ёжҖ§жә¶ж¶ІгҖҒзҹіи•ҠиҜ•ж¶І
еҰӮеӣҫжүҖзӨәпјҢйҡ”жқҝIеӣәе®ҡдёҚеҠЁпјҢжҙ»еЎһв…ЎеҸҜиҮӘз”ұ移еҠЁпјҢMгҖҒNдёӨдёӘе®№еҷЁдёӯеқҮеҸ‘з”ҹеҸҚеә”пјҡAпјҲgпјү+2BпјҲgпјүвҮҢxCпјҲgпјүв–іH=п№Ј192kJвҖўmolп№Ј1пјҢеҗ‘MгҖҒNдёӯйғҪйҖҡе…Ҙ1mol Aе’Ң2mol Bзҡ„ж··еҗҲж°”дҪ“пјҢеҲқе§ӢMгҖҒNе®№з§ҜзӣёеҗҢпјҢдҝқжҢҒжё©еәҰдёҚеҸҳпјҺдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
![]()
![]()
AпјҺиӢҘx=3пјҢиҫҫеҲ°е№іиЎЎеҗҺAзҡ„дҪ“з§ҜеҲҶж•°е…ізі»дёәпјҡПҶпјҲMпјүпјһПҶпјҲNпјү
BпјҺиӢҘxпјһ3пјҢиҫҫеҲ°е№іиЎЎеҗҺBзҡ„иҪ¬еҢ–зҺҮе…ізі»дёәпјҡОұпјҲMпјүпјһОұпјҲNпјү
CпјҺиӢҘxпјң3пјҢCзҡ„е№іиЎЎжө“еәҰе…ізі»дёәпјҡcпјҲMпјүпјһcпјҲNпјү
DпјҺxдёҚи®әдёәдҪ•еҖјпјҢиө·е§Ӣж—¶еҗ‘Nе®№еҷЁдёӯе……е…Ҙд»»ж„ҸеҖјзҡ„CпјҢе№іиЎЎеҗҺNе®№еҷЁдёӯAзҡ„жө“еәҰеқҮзӣёзӯү
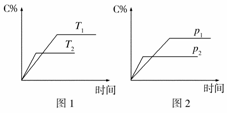
еҸҜйҖҶеҸҚеә”A(пјҹ)пјӢaB(g)![]() C(g)пјӢ2D(g)(aдёәжӯЈж•ҙж•°)гҖӮеҸҚеә”иҝҮзЁӢдёӯпјҢеҪ“е…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢCзҡ„зҷҫеҲҶеҗ«йҮҸ(C%)дёҺжё©еәҰ(T)е’ҢеҺӢејә(p)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖгҖҖ)
C(g)пјӢ2D(g)(aдёәжӯЈж•ҙж•°)гҖӮеҸҚеә”иҝҮзЁӢдёӯпјҢеҪ“е…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢCзҡ„зҷҫеҲҶеҗ«йҮҸ(C%)дёҺжё©еәҰ(T)е’ҢеҺӢејә(p)зҡ„е…ізі»еҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В (гҖҖгҖҖ)
AпјҺиӢҘaпјқ2пјҢеҲҷAдёәж¶ІжҖҒжҲ–еӣәдҪ“
BпјҺиҜҘеҸҚеә”зҡ„жӯЈеҸҚеә”дёәж”ҫзғӯеҸҚеә”
CпјҺT2>T1пјҢp2>p1
DпјҺе…¶д»–жқЎд»¶дёҚеҸҳпјҢеўһеҠ Bзҡ„зү©иҙЁзҡ„йҮҸпјҢе№іиЎЎжӯЈеҗ‘
移еҠЁпјҢе№іиЎЎеёёж•°KеўһеӨ§
дёӢеҲ—е…ідәҺеӣҫжүҖзӨәеҺҹз”өжұ иЈ…зҪ®зҡ„еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜпјҲгҖҖгҖҖпјү
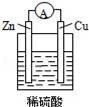

AпјҺй“ңзүҮжҳҜиҙҹжһҒВ В BпјҺй“ңзүҮиҙЁйҮҸйҖҗжёҗеҮҸе°‘
CпјҺз”өжөҒд»Һй”ҢзүҮз»ҸеҜјзәҝжөҒеҗ‘й“ңзүҮ DпјҺж°ўзҰ»еӯҗеңЁй“ңзүҮиЎЁйқўиў«иҝҳеҺҹ
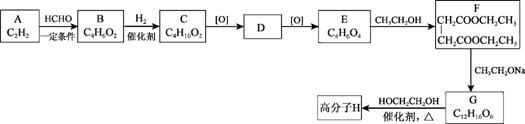
.й«ҳеҲҶеӯҗHжҳҜдәәйҖ жЈүзҡ„жҲҗеҲҶд№ӢдёҖпјҢе…¶еҗҲжҲҗи·ҜзәҝеҰӮдёӢпјҡ
е·ІзҹҘпјҡв… .R1COOR2+R3CH2COOR4![]()
 +R2OH
+R2OH
в…Ў.RCOORвҖҷ+RвҖқOH![]() RCOORвҖқ+RвҖҷOH
RCOORвҖқ+RвҖҷOH
(R1гҖҒR2гҖҒR3гҖҒR4гҖҒRвҖҷгҖҒRвҖқд»ЈиЎЁзғғеҹә)
(1)жҢүе®ҳиғҪеӣўеҲҶзұ»пјҢAзҡ„зұ»еҲ«жҳҜ_______гҖӮ
(2)BдёәдёҚйҘұе’ҢйҶҮпјҢAвҶ’Bзҡ„еҸҚеә”зұ»еһӢжҳҜ_______гҖӮ
(3)Cзҡ„еҗҚз§°жҳҜ_______гҖӮ
(4)Dзҡ„ж ёзЈҒе…ұжҢҜж°ўи°ұжҳҫзӨәе…¶еҲҶеӯҗжңү2з§ҚдёҚеҗҢзҺҜеўғзҡ„ж°ўеҺҹеӯҗпјҢDзҡ„з»“жһ„з®ҖејҸжҳҜ_______гҖӮ
(5)EвҶ’Fзҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜ_______гҖӮ
(6)GеҲҶеӯҗеҶ…еҗ«жңүдёҖдёӘе…ӯе…ғзҺҜ(еҗ«вҖң![]() вҖқз»“жһ„)гҖӮ
вҖқз»“жһ„)гҖӮ
в‘ дёӢеҲ—иҜ•еүӮиғҪдҪҝ![]() иҪ¬еҢ–дёә
иҪ¬еҢ–дёә![]() зҡ„жҳҜ_______(еЎ«еәҸеҸ·)гҖӮ
зҡ„жҳҜ_______(еЎ«еәҸеҸ·)гҖӮ
a.![]() В В В В В В В В b.
В В В В В В В В b.![]() В В В В В В В В c.
В В В В В В В В c.![]()
в‘Ў GвҶ’Hзҡ„еҸҚеә”зұ»еһӢдёәзј©иҒҡеҸҚеә”пјҢиҜҘеҸҚеә”иҝҳжңү![]() з”ҹжҲҗпјҢе…¶еҢ–еӯҰж–№зЁӢејҸжҳҜ_______гҖӮ
з”ҹжҲҗпјҢе…¶еҢ–еӯҰж–№зЁӢејҸжҳҜ_______гҖӮ
еҸіеӣҫдёӯжЁӘеқҗж ҮдёәеҠ е…ҘеҸҚеә”зү©зҡ„зү©иҙЁзҡ„йҮҸпјҢзәөеқҗж Үдёәдә§з”ҹжІүж·ҖжҲ–ж°”дҪ“зҡ„зү©иҙЁзҡ„йҮҸгҖӮдёӢеҲ—еҸҚеә”еҜ№еә”зҡ„жӣІзәҝй”ҷиҜҜзҡ„жҳҜпјҲВ В В пјү
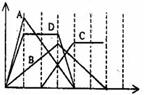
AпјҺеҗ‘NaAlO2жә¶ж¶Ідёӯж»ҙе…ҘHClиҮіиҝҮйҮҸ
BпјҺеҗ‘жҫ„жё…зҹізҒ°ж°ҙдёӯйҖҡе…ҘCO2иҮіиҝҮйҮҸ
CпјҺеҗ‘Na2CO3жә¶ж¶Ідёӯж»ҙе…Ҙзӣҗй…ёиҮіиҝҮйҮҸ
DпјҺеҗ‘еҗ«жңүзӯүзү©иҙЁзҡ„йҮҸзҡ„KOHгҖҒBa(OH)2зҡ„ж··еҗҲжә¶ж¶ІдёӯйҖҡе…ҘCO2иҮіжІүж·Җж¶ҲеӨұ
еҸ–a gжҹҗзү©иҙЁеңЁO2дёӯе®Ңе…ЁзҮғзғ§пјҢе°Ҷз”ҹжҲҗзү©дёҺи¶ійҮҸNa2O2еӣәдҪ“е®Ңе…ЁеҸҚеә”пјҢеҸҚеә”еҗҺпјҢеӣәдҪ“иҙЁйҮҸжҒ°еҘҪд№ҹеўһеҠ дәҶa gпјҢдёӢеҲ—зү©иҙЁдёҚиғҪж»Ўи¶ідёҠиҝ°з»“жһңзҡ„жҳҜВ В В В В В В В В В В (гҖҖ гҖҖ)
AпјҺH2В В В В В В В В В BпјҺCO В В В В В В В В В В CпјҺC12H22O11 В В В В В В В В В DпјҺC6H12O6
й“ҒгҖҒй’ҙ(Co)гҖҒй•Қ(Ni)жҳҜеҗҢж—Ҹе…ғзҙ пјҢдё»иҰҒеҢ–еҗҲд»·еқҮдёә+2гҖҒ+3д»·пјҢйғҪжҳҜиҫғжҙ»жіјзҡ„йҮ‘еұһпјҢе®ғ们зҡ„еҢ–еҗҲзү©еңЁе·ҘдёҡдёҠжңүйҮҚиҰҒзҡ„еә”з”ЁпјҺ
(1)й…ҚеҲ¶FeSO4жә¶ж¶Іж—¶пјҢйңҖеҠ е…ҘзЁҖзЎ«й…ёпјҢе…¶зӣ®зҡ„жҳҜ_________________________
(2)еҶҷеҮәCoCl2дёҺж°Ҝж°ҙеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸ______________________________
(3) Co2+е’ҢFe3+еқҮеҸҜдёҺKSCNжә¶ж¶ІеҸ‘з”ҹзӣёдјјзҡ„еҸҚеә”пјҢеҗ‘CoCl2жә¶ж¶ІдёӯеҠ е…ҘKSCNжә¶ж¶ІпјҢз”ҹжҲҗжҹҗз§Қи“қиүІзҰ»еӯҗпјҢиҜҘзҰ»еӯҗдёӯй’ҙе…ғзҙ зҡ„иҙЁйҮҸеҲҶж•°зәҰдёә20%гҖӮеҲҷиҜҘзҰ»еӯҗзҡ„еҢ–еӯҰејҸдёә__________________гҖӮВ
(4)зўій…ёй•ҚеҸҜз”ЁдәҺз”өй•ҖгҖҒйҷ¶з“·еҷЁзқҖиүІзӯүгҖӮй•ҚзҹҝжёЈдёӯй•Қе…ғзҙ зҡ„дё»иҰҒеӯҳеңЁеҪўејҸжҳҜNi(OH)2е’ҢNiSпјҢд»Һй•ҚзҹҝжёЈеҮәеҸ‘еҲ¶еӨҮзўій…ёй•Қзҡ„еҸҚеә”еҰӮдёӢпјҡ
е…Ҳеҗ‘й•ҚзҹҝжёЈдёӯеҠ е…ҘзЁҖзЎ«й…ёе’ҢNaClO3жөёеҸ–еҮәNi2+пјҢеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжңүв‘ _____________________в‘ЎNiS+ ClO3пјҚ+H+пјҚNi2++S+ClпјҚ+H2O(жңӘй…Қе№і)пјҢжӯӨеҸҚеә”дёӯиҝҳеҺҹдә§зү©дёҺж°§еҢ–дә§зү©зҡ„зү©иҙЁзҡ„йҮҸжҜ”дёә_________гҖӮеҶҚеҠ е…ҘNa2CO3жә¶ж¶ІжІүй•ҚпјҢеҚіеҲ¶еҫ—зўій…ёй•ҚпјҢжЈҖйӘҢNi2+жҳҜеҗҰжІүж·Җе®Ңе…Ёзҡ„ж–№жі•_____________________________________
жҹҗжңүжңәзү©XеҠ ж°ўеҸҚеә”еҗҺзҡ„иҝҳеҺҹдә§зү©жҳҜCH3CHпјҲCH3пјүCH2OHпјҢе…ідәҺXзҡ„дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ
AпјҺXеҸҜиғҪжҳҜд№ҷйҶӣзҡ„еҗҢзі»зү©В BпјҺXеҸҜиғҪжҳҜжӯЈдёҒйҶҮзҡ„еҗҢеҲҶејӮжһ„дҪ“
CпјҺXеҸҜиғҪжҳҜд№ҷзғҜзҡ„еҗҢеҲҶејӮжһ„дҪ“В DпјҺXеҲҶеӯҗдёӯеҸҜиғҪжңүзўізўіеҸҢй”®
е·ІзҹҘжҹҗжё©еәҰдёӢж°ўж°°й…ё(HCN)зҡ„з”өзҰ»е№іиЎЎеёёж•°жҳҜ6.4Г—10пјҚ10пјҲmol/Lпјү2гҖӮиҜ·и®Ўз®—пјҡ
пјҲ1пјүеёёжё©дёӢпјҢ1 mol/Lзҡ„ж°ўж°°й…ёжә¶ж¶ІдёӯH+жө“еәҰеҸҠPHгҖӮ
пјҲ2пјүеңЁиҜҘй…ёжә¶ж¶Ідёӯз”ұж°ҙз”өзҰ»дә§з”ҹзҡ„ж°ўж°§ж №зҰ»еӯҗзҡ„жө“еәҰгҖӮ



