高三化学试题
像对待生命一样对待生态环境” ,下列做法不符合这一思想的是( )
A.推广使用可降解塑料及布质购物袋,以减少“白色污染”
B.用Ba(OH)2消除水中Cu2+等重金属离子污染
C.汽油抗爆:甲基叔丁基醚代替四乙基铅
D.大力推广燃料“脱硫、脱硝”技术,减少硫氧化物和氮氧化物对空气的污染
将Na2O2逐渐加入到含有H+、Mg2+、Al3+、NH4+的混合液中并微热,产生沉淀和气体的物质的量(mol)与加入的Na2O2物质的量(mol)的关系如图所示,则原溶液中的Mg2+、Al3+、NH4+物质的量分别
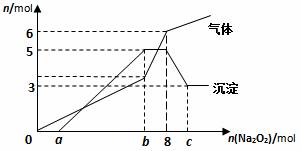
A. 2 mol、3 mol、6 mol B. 3 mol、2 mol、6mol
C. 2 mol、3 mol、4 mol D. 3 mol、2 mol、2 mol
“中国名片”中航天,军事、天文等领城的发展受到世界瞩目,它们与化学有着密切联系。下列说法错误的是
A. “中国天眼”的“眼眶”是钢铁结成的圈梁,其属于黑色金属材料
B. “歼—20” 飞机上大量使用的碳纤维是一种新型有机高分子材料
C. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷是新型无机非金属材料
D. “天宫二号”空间实验室的硅电池板将光能直接转换为电能
铅蓄电池的化学反应为:PbO2 + 2H2SO4 + Pb
A.充电时转移1mol电子则生成0.5mol H2SO4
B.放电时正极的电极反应为:PbO2 + 4H+ + SO42― + 2e― = PbSO4 + 2H2O
C.充电时,电池上标注“+”的电极应与外接电源的正极相连
D.放电时,Pb失电子发生氧化反应
铜及其化合物在生产、生活中有广泛应用。回答下列问题:
(1)铜和锌相邻,铜和锌的几种状态:①铜:[Ar]3d10;②铜:[Ar]3d104s1③铜:[Ar]3d104p1④锌:[Ar]3d104s1⑤锌:[Ar]3d104s2。它们都失去1个电子时需要的能量由大到小排序为 ___(填字母)。
a.①⑤④②③ b.①④⑤②③ c.②①③⑤④ d.⑤①④③②
画出基态铜原子的价电子排布图____。
(2)Cu2+与NH3·H2O等形成配离子。[Cu(NH3)4]2+中2个NH3被2个H2O取代得到两种结构的配离子,则[Cu(NH3)4]2+的空间构型是____(填“正四面体”或“正四边形”)。
(3)CuF2晶体的熔点为836℃。其能量循环图示如下(a、b、c 等均大于0):

F-F键能为 ___kJ∙mol-1,CuF2(s)的晶格能为 ___kJ∙mol-1。
(4)铜常作醇氧化反应的催化剂。M中C原子的杂化类型有 ___种,M的熔沸点比N的高,原因是 ___。
![]()
![]()
![]()
(5)磷青铜晶胞结构如图所示。NA代表阿伏加德罗常数的值,铜、磷原子最近距离为![]()

①铜与铜原子最近距离为____nm。
②磷青铜晶体密度为___ g∙cm-3(用代数式表示)。
A、B、C、D、E、F是六种短周期主族元素,其中D、E同主族,C、E同周期,A的核电荷数等于其电子层数,B、D形成的化合物可用于制不粘锅的保护膜,B、E形成的某种化合物是一种常见的有机溶剂,C的次外层电子数是最外层电子数的4倍,D的单质可与水反应置换出F的单质。下列说法不正确的是
A.离子半径:E>F>D>C>A B.含氧酸的酸性可能为:B>E
C.A、B、F形成的某种化合物可使澄清石灰水变浑浊 D.A与C形成的化合物溶于水显酸性
如下图所示,A、B、C是实验室常用的三种制取气体的装置,提供的药品有:大理石、浓盐酸、锌粒、稀盐酸、二氧化锰、氯化铵、熟石灰。现欲利用这些药品分别制取NH3、Cl2、H2、CO2四种气体,试回答以下问题:

(1)选用A装置可制取的气体有________;选用B装置可制取的气体有________;通常选用C装置制取的气体有________。
(2)标号为①、②的仪器名称依次是________、______________。
(3)写出利用上述有关药品制取Cl2的离子方程式:_______________________________。
碱性锌锰电池的工作原理:Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2,其中的电解质溶液是KOH溶液。某课题组用废旧铁壳无汞碱性锌锰电池为原料,制备一种新型材料——MnxZn(1−x)Fe2O4,其工艺流程如图所示:

(1)已知MnxZn(1−x)Fe2O4中锰元素的化合价与实验室用二氧化锰制取氯气时还原产物中的锰相同,则铁元素的化合价为___________。
(2)“溶渣”工序中稀硫酸与铁反应生成的硫酸亚铁可将+3价锰的化合物全部还原成Mn2+,写出该反应的离子方程式:_________________________________。
(3)“调铁”工序的目的是调整滤液中铁离子的总浓度,使其中金属元素的物质的量之比与产品的化学式MnxZn(1−x)Fe2O4相符合。
①写出“调铁”工序中发生反应的离子方程式:______________________、___ ____。
②若测得滤液的成分为c(Mn2+)+c(![]() Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为__________kg(忽略溶液体积变化,用含a、b的代数式表示)。
Zn2+)=a mol·L−1,c(Fe2+)+c(Fe3+)=b mol·L−1,滤液体积为1 m3,“调铁”工序中,需加入的铁粉质量为__________kg(忽略溶液体积变化,用含a、b的代数式表示)。
(4)在“氧化”工序中,加入双氧水的目的是把Fe2+氧化为Fe3+;生产过程中发现实际消耗双氧水的量大于理论值,其可能原因除温度外,主要是______________________。
(5)用氨水“调pH”后,经“结晶”、“过滤”可得到产品和滤液C,从滤液C中还可分离出一种氮肥,该氮肥的溶液中离子浓度由大到小的排序为_______________。
下列说法正确的是( )
A.投入铁片产生H2的溶液中可大量存在H+、Mg2+、SO![]() 、NO
、NO![]()
B.将过量二氧化硫气体入冷氨水中:SO2+NH3·H2O===HSO![]() +NH
+NH![]()
C.用酒精萃取碘水中的碘,水从分液漏斗下口放出,碘的酒精溶液从分液漏斗上口倒出
D.高炉炼铁原理是用一氧化碳还原四氧化三铁
化合物M是一种常用的液晶材料。以苯的同系物A、G为原料合成M的一种路线(部分反应条件略去)如下:

已知:![]() +
+![]() , 回答下列问题:
, 回答下列问题:
(1)M的结构简式为________ ,A的名称为___________。
(2)D中官能团的名称是________
(3)②的反应类型是_________,⑥的反应类型是___________。
(4)⑤的化学方程式为_______________。
(5)满足以下条件的B的同分异构体有_______________种(不考虑立体异构)。
①能与氯化铁溶液发生显色反应;②苯环上只有两个取代基;③除苯环以外没有其它环状结构
(6)参照上述合成路线,设计一条由苯乙烯和甲苯为起始原料制备![]() 的合成路线:
的合成路线:
下列家庭小实验中不涉及化学变化的是( )
A.用铁钉等材料探究铁生锈的条件
B.用糯米、酒曲和水制甜酒
C.用75%的酒精杀菌消毒
D.用木炭除去冰箱中的异味
下列各组物质的性质比较,正确的是 ( )
A.酸性:HClO4>H3PO4>H2SO4
B.氢化物稳定性:H2S>HF>H2O
C.碱性:NaOH>Mg(OH)2>Ca(OH)2
D.氧化性:F2>Cl2>Br2>I2
已知A为常见金属,X、Y为常见非金属,X、E、F、G常温下为气体,常温下C为无色液体,B是一种盐,受热极易分解,在工农业生产中用途较广(如被用作某些电池的电解质).现用A与石墨作电极,B的浓溶液作电解质,构成原电池.有关物质之间的转化关系如图:(注意:其中有些反应的条件及部分生成物被略去)

请填写下列空白:
(1)反应④为A在某种气体中燃烧,生成单质Y和A的氧化物,其反应方程式为:
(2)从D溶液制备D的无水晶体的“操作a”为
(3)反应②的化学方程式为
(4)反应⑤的化学方程式为
(5)原电池反应①中正极的电极反应式为
(6)已知E可与次氯酸钠溶液反应生成K,K和E的组成元素相同,且一分子K中有18个电子,则K的电子式为
(7)检验气体E的试剂及现象是 .
对于反应14CuSO4+5FeS2+12H2O===7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
A.只有硫酸铜作氧化剂
B.SO![]() 既不是氧化产物又不是还原产物
既不是氧化产物又不是还原产物
C.被氧化的硫与被还原的硫的质量比为3∶7
D.1 mol硫酸铜可以氧化![]() mol的硫
mol的硫
雾霾严重影响人们的生活与健康。某地区的雾霾中可能含有如下可溶性无机离子:Na+、NH4+、Mg2+、Al3+、SO42-、NO3-、Cl- 。某同学收集了该地区的雾霾,经必要的预处理后试样溶液,设计并完成了如下的实验:

已知:3NO3-+ 8Al + 5OH- + 2H2O![]() 3NH3↑+ 8AlO2-
3NH3↑+ 8AlO2-
根据以上的实验操作与现象,该同学得出的结论不正确的是( )
A.试样中一定不含Al3+
B.试样中肯定存在NH4+、Mg2+、SO42-和NO3-
C.试样中可能存在Na+、Cl-
D.该雾霾中可能存在NaNO3 、NH4Cl和MgSO4
a、b、c、d为短周期元素,a的M电子层有1个电子,b的一种核素14b常用于鉴定文物年代,c的最高价化合物与最低价化合物代数和为4,d的低价含氧酸能杀菌、消毒、漂白。下列叙述不正确的是
A. 最高价含氧酸酸性:d>c>b B. 它们均存在两种或两种以上的氧化物
C. b与氢形成的化合物只存在极性共价键
D. a、b、c的离子半径依次增大
科学家在《Science》上发表论文,宣布发现了铝的超原子结构Al13和Al14,当这类超原子具有40个价电子(对于主族元素的原子,外围电子又称为价电子)时最稳定,在质谱仪上可检测到稳定到Al13-和Al142+。下列说法错误的是
A.Al13和Al14互为同位素
B.Al13超原子中Al原子间是通过共价键结合的
C.Al13和Al的化学性质相似,都具有较强的还原性
D.Al14和稀盐酸反应的化学方程式可表示为Al14+2HCl→Al14Cl2+H2↑
某混合溶液中, 含溶质X、Y各0.1 mol, 向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如下图, 则符合条件的X、Y、Z分别是( )
A.氯化铝、 氯化铁、 氢氧化钠
B.氯化铝、 氯化镁、 氢氧化钠
C.偏铝酸钠、 氯化钡、 硫酸
D.偏铝酸钠、 氢氧化钡、 硫酸

某学生用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(每次加入的盐酸的物质的量浓度相等),下列分析不正确的是( )
| 盐酸 /mL | 50 | 50 | 50 |
| m(混合物)/g | 9.2 | 15.7 | 27.6 |
| V(CO2)(标况)/L | 2.24 | 3.36L | 3.36L |
A.盐酸的物质的量浓度为3.0mol/L
B.根据表中数据能计算混合物中NaHCO3的质量分数
C.加入混合物9.2g时盐酸过量
D.15.7g混合物恰好与盐酸完全反应



