初中 化学
-
(1) 氧和碳是人体中含量最多的两种元素,它们的本质区别是不同.
-
(2) 图是某反应的微观过程示意图.该反应的化学方程式为;氯化钠由构成.
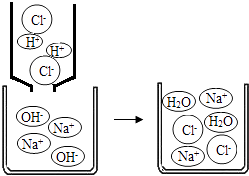
-
(3) 表中4个微观示意图分别表示4种物质的微粒.
微观示意图





若
 表示A,A和B在一定条件下反应生成C和D,则C和D的化学式分别为,生成C和D的个数比为.
表示A,A和B在一定条件下反应生成C和D,则C和D的化学式分别为,生成C和D的个数比为.
| 选项 | 实验目的 | 实验方案 |
| A | 比较Cu和Ag的金属活动性顺序 | 将银片放入硫酸铜溶液 |
| B | 除去CO2气体中的HCl | 将气体通过盛有足量NaOH溶液的洗气瓶 |
| C | 鉴别硬水和软水 | 取样,滴加肥皂水 |
| D | 除去FeCl2溶液中的CuCl2 | 加入过量的铁粉,充分反应后过滤 |
[提出猜想] 甜叶菊苷由什么元素组成?
[进行实验]小晴取适量的甜叶菊苷按图进行操作,并分别将干冷的烧杯和蘸有澄清石灰水的烧杯倒置与火焰上方。

-
(1) [讨论交流]其他同学认为小晴的实验设计不严谨,原因是。经改进试验后,检验到甜叶菊苷在氧气中充分燃烧的产物只有二氧化碳和水,由此确定甜叶菊苷中一定含有碳,氢元素。
-
(2) [继续探究]为了进步确定其元素组成。利用下图进行实验。(已知:装置中C中的氧化铜能确保甜叶菊苷中的碳元素完全转化为二氧化碳)

实验前要通一会儿氮气,目的是。
-
(3) A装置中发生反应的化学方程式为。
-
(4) [数据记录]4.02g甜叶菊苷在C装置中充分燃烧后,D装置增重2.7g, E装置增重8.36g。(产物被完全吸收)
[分析与结论]数据分析: 4.02g 甜叶菊苷中氧元素的质量为g,由此可以确定甜叶菊苷是由碳,氢,氧元素组成。
-
(5) [反思评价]若没有F装置,对氧元素质量测定结果的影响是。 (填“偏大”、“偏小”或“无影响”)。
 两份完全相同的双氧水完全分解
B .
两份完全相同的双氧水完全分解
B .  在密闭容器中用红磷测定空气中氧气的含量
C .
在密闭容器中用红磷测定空气中氧气的含量
C .  通电使水分解
D .
通电使水分解
D . 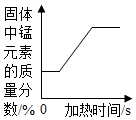 加热分解氯酸钾和二氧化锰的固体混合物至完全反应
加热分解氯酸钾和二氧化锰的固体混合物至完全反应
某兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验.

-
(1) (1)请写出镁条与氧气反应的化学方程式 .
(2)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律.我 (“同意”或“不同意”)小明的观点,因为 .
(3)小红按如图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体.
-
(2) [提出问题]黄色固体是什么呢?
[查阅资料]
①氧化镁为白色固体
②镁能与氮气反应生成黄色的氮化镁(Mg3N2)固体;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝.
[做出猜想]黄色固体为Mg3N2
实验操作
实验现象及结论
-
(3) [反思与交流]空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的氧化镁却远多于氮化镁,为什么?请给出合理的解释 .
(4)该兴趣小组又做了镁条与盐溶液反应的实验,发现均能产生H2 , 实验现象如下:
实验序号
实验1
实验2
实验3
/
镁条反应的溶液
NH4Cl
NaCl
Na2SO4
H2O
实验现象
有大量气泡产生
有较多气泡产生
有少量气泡产生
气泡极少
加热后实验现象
气泡明显增多.可闻到氨味
气泡增多
气泡增多
气泡增多
上表中,用水进行实验的目的是 .
根据上表中的实验现象,请写出三条结论,并分析可能的原因:
① ;
② ;
③ .

-
(1) 配制一定质量分数的氯化钠溶液,需进行操作①-⑤,实验步骤为计算、称量和。
-
(2) 除去粗盐中难溶性杂质,需要进行操作⑥,该操作的名称是。
-
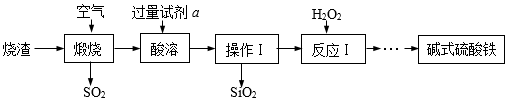
(1) 操作Ⅰ中所用的玻璃仪器有烧杯、漏斗、。
-
(2) 煅烧时产生的SO2可选用石灰乳而不用澄清石灰水吸收的原因是。
-
(3) 酸溶时加入的试剂a是(填序号)。
a.H2SO4
b.HCl
c.HNO3
-
(4) 反应Ⅰ中加双氧水的目的是为了将酸性FeSO4溶液氧化为Fe2(SO4)3 , 反应的化学方程式为。
贝壳主要由95%左右的CaCO3与5%左右的贝壳素构成,是一种天然的生物资源,拥有非常高的利用价值。
贝壳经过高温煅烧等加工处理后,可用来制作建筑材料、动物和人体所需的钙补充剂。
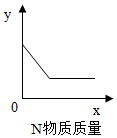
贝壳具有多级层状结构,拥有良好的吸附性,可用作污水、土壤中重金属的吸附剂。研究人员用贝壳粉和CaCO3粉末分别对某土壤样品(被铅蓄电池污染)中Pb吸附效果进行实验,结果如图。
贝壳经加工可用于涂料,贝壳涂料具有隔热保温功能。研究人员对贝壳涂料的隔热保温功能进行了实验:制作4个相同的纸箱模拟封闭建筑。甲作为对照不涂刷涂料,乙在内壁涂刷涂料,丙在外壁涂刷涂料,丁在内壁和外壁涂刷涂料。干燥后,将68℃500mL的水同时放入四个纸箱中,自然冷却45min,测量水温,结果如下表。
甲 | 乙 | 丙 | 丁 | |
温度/℃ | 50.7 | 52 | 52.5 | 52.5 |

贝壳具有广泛应用前景,若能有效利用,必会产生巨大经济和环保生态效益。
(原文作者崔童、赵镇东等,有删改)
依据文章内容回答下列问题。
-
(1) 贝壳中CaCO3所占比例约为。
-
(2) 在保温领域,贝壳涂料涂刷在(填“内壁”或“外壁”)效果更好。
-
(3) 判断下列说法是否正确(填“对”或“错”)。
①贝壳可以用作吸附剂,是因为它具有多级层状结构。。
②贝壳是制作动物和人体所需的钙补充剂的一种原料。。
-
(4) 根据图实验,得出的结论是。
| M | N | y | |
| A | 水 | 浓硫酸 | 溶液的温度 |
| B | 水 | 氢氧化钠溶液 | 溶液的pH |
| C | 饱和氯化钠溶液 | 氯化钠 | 溶液的溶质质量分数 |
| D | 硫酸铜 | 铁粉 | 溶液的质量 |
下列有关实验操作的说法不正确的是( )
A. 蒸馏完毕后,应先停止加热,待装置冷却后,停止通水,再拆卸蒸馏装置
B. 将98%的浓硫酸沿烧杯壁缓慢地注入盛有水的烧杯里,并用玻璃棒不断搅拌稀释
C. 分液漏斗使用前必须检查是否漏液
D. 在测定溶液的pH时,先用蒸馏水湿润试纸,后用玻璃棒蘸取溶液点在试纸中部,再与比色卡比较,读出该溶液的pH
某专用仓库,要求控制库内空气中的氧气的含量,需![]() 要对库内气体取样检验。现有可选用的实验仪器如下:橡皮管、集气瓶、玻璃片、盛满水的水槽、烧杯和漏斗。你怎样用最简单的方法取出仓库内气体的样品?
要对库内气体取样检验。现有可选用的实验仪器如下:橡皮管、集气瓶、玻璃片、盛满水的水槽、烧杯和漏斗。你怎样用最简单的方法取出仓库内气体的样品?
为研究NaOH与盐酸的反应,同学们用以下试剂设计不同方案进行探究.
实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等
(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应.反应的化学方程式为 .
(2)小刚取体积相同的稀盐酸分别于甲、乙两支试管中,向甲中先加1mL水,充分混合后再放入镁条,向乙中先加入1mL NaOH溶液,充分混合后再放入镁条.观察到 ,可推断NaOH与盐酸发生了反应.
(3)小华利用溶液导电性进行实验.分别测定几种试剂的导电性,获得相关数据:
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
查阅资料:
I.溶液中若存在自由移动的离子,通电时就会发生定向移动,从而形成了电流.
II.相同电压下,等体积溶液中,所含离子数目越多,电流就越大.
①对比实验A、C的数据,可推知NaOH溶液中除水分子外还含有自由移动的 和 (填化学符号).
②实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl﹣的数目 (填写“相等”或“不相等”).
③各取10mL NaOH溶液于两个小烧杯中,分别加入10mL NaCl溶液和10mL稀盐酸(所得混合溶液体积均约为20mL),测两种混合溶液的导电性,电流示数依次为I1和I2.根据I1 I2(填“>”、“<”或“=”),也可推断氢氧化钠和盐酸发生了反应.
下列归纳总结完全正确的一组是
| A.化学与社会发展 | B.化学与健康 |
| ①广泛使用太阳能能有效减少碳排放 ②普通玻璃属于无机非金属材料 ③煤燃烧产生的二氧化硫易形成酸雨 | ①缺碘会引起骨质疏松 ②糖类是人体最主要的供能物质 ③为补充蛋白质只吃肉类不吃蔬菜 |
| C.化学与安全 | D.化学实验中的先与后 |
| ①进入溶洞前做灯火实验 ②煤气泄露立即开灯查找泄露 ③煤炉上放盆水防止CO中毒 | ①制取气体:先加药品后检查装置气密性能 ②称量一定质量药品:先加药品后加砝码 ③可燃性气体燃烧:先验纯后点燃 |
A.A B.B C.C D.D
剧烈运动时肌肉里产生乳酸(C3H6O3),会导致肌肉酸痛。下列说法错误的是( )
A.乳酸的相对分子质量为90 B.乳酸由碳、氢、氧三种元素组成
C.乳酸中氧元素的质量分数最大 D.乳酸中碳、氢、氧元素质量之比为1:2:1
按下列要求各写一个化学方程式(1分×4=4分)
(1)实验室用固体混合物制氧气
(2)高炉中炼铁的原理
(3)用纯碱制烧碱
(4)波尔多液不能用铁制容器盛装
(2018·苏州)某溶液中存在较多的H+、S![]() 、Cl-,该溶液中还可能大量存在的离子是 ( )
、Cl-,该溶液中还可能大量存在的离子是 ( )
A.OH- B.Ba2+ C.N![]() D.Ag+
D.Ag+



