湖北2018年高三下期化学高考模拟在线免费考试
| 1. | 详细信息 |
|
下列有关说法错误的是 A. 使用含有氯化钙的融雪剂会加快桥梁的腐蚀 B. 为使鲜花保鲜,可在箱内放入高锰酸钾溶液浸泡过的硅藻土 C. 雾霾是一种分散系,戴活性炭口罩的原理是吸附作用 D. 常用危险化学品标志中的数字主要表示的是危险的级别 |
|
| 2. | 详细信息 |
|
下列说法不正确的是 A. 钛被称为继铁、铝之后的第三金属,但目前主要用于尖端领域,是因为其制备或冶炼的成本远高于铁或铝 B. 配制一定物质的量浓度的溶液时,固体溶解后未冷却就立即转移到容量瓶中定容,会使所配溶液浓度偏大 C. 用酒精灯加热铝箔可使铝箔熔化,但熔化的铝并不滴落,是因为构成铝表面薄膜的氧化铝的熔点高于铝的熔点 D. 胶体粒子的直径大于可见光的波长,能使光波发生散射 |
|
| 3. | 详细信息 |
|
苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图,下列说法不正确的是 A. 分子式为C8H7OCl B. 在同一平面上的碳原子最多有8个 C. 1摩尔苯氯乙酮最多可与3摩尔氢气发生加成反应 D. 不存在与它同一类别的同分异构体 |
|
| 4. | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是 A. 0.1molO2完全反应时,转移的电子数一定为0:4NA B. 在标准状况下,1molSO3体积约为22.4 L C. 含1molFeCl3的饱和溶液最多可形成胶体粒子数为NA D. 1mol 葡萄糖与足量的钠反应能产生2.5molH2 |
|
| 5. | 详细信息 | |||||||||||||||
下列评价合理的是
|
||||||||||||||||
| 6. | 详细信息 |
25℃时,将pH均为2 的HCl与HX 的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法不正确的是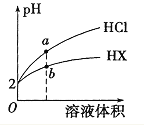 A. a、b两点: c(X-) < c(Cl-) B. 溶液的导电性: a < b C. 稀释前,c(HX) > 0.01mol/L D. 溶液体积稀释到10倍,HX 溶液的pH < 3 |
|
| 7. | 详细信息 |
|
m、n、p、q 为原子序数依次增大的短周期主族元素,四种原子最外层电子数之和为18,n3-与p2+ 具有相同的电子层结构。下列叙述中错误的是 A. m、n、q一定是非金属元素 B. 氢化物的沸点: q>n>m C. 离子半径的大小: q>n>p D. m 与q形成的二元化合物一定是共价化合物 |
|
| 8. | 详细信息 |
铝氢化钠(NaAlH4) 是有机合成的重要还原剂。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质) 为原料制备铝氢化钠的一种工艺流程如下: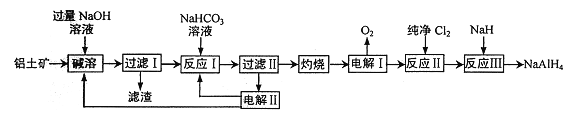 注: SiO2在“碱溶”时转化为铝硅酸钠(Na2Al2SixO8) 沉淀。 (1)铝硅酸钠(Na2Al2SixO8) 可以用氧化物的形式表示其组成,形式为________。 (2) “过滤I”中滤渣主要成分有________(写名称)。向“过滤I”所得滤液中加入NaHCO3溶液,反应的离子方程式为_______________、______________。 (3) “电解I”的另一产物在1000℃时可与N2反应制备AlN,在这种产物中添加少量NH4Cl固体并充分混合,有利于AlN 的制备,其主要原因是__________________。 (4)“电解II”是电解Na2CO3溶液,原理如图所示。  阳极的电极反应式为_________________。 (5)铝氢化钠遇水发生剧烈反应产生大量气泡,其反应的化学方程式为_____________,每产生1mol 气体转移电子数为______。 |
|
| 9. | 详细信息 |
氢能是理想的清洁能源,资源丰富。以太阳能为热源分解Fe3O4,经由热化学铁氧化合物循环分解水制H2的过程如下: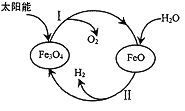 (1)过程I :2Fe3O4(s) ①过程I需要将O2不断分离出去,目的是______________。 ②一定温度下,在容积可变的密闭容器中,该反应已达到平衡。下列说法正确的是____(填字母标号) 。 a.容器内气体密度和相对分子质量都不再改变 b.升高温度,容器内气体密度变大 c.向容器中通入N2,Fe3O4 转化率不变 d.缩小容器容积,O2(g)浓度变大 ③在压强p1下,Fe3O4的平衡转化率随温度变化的曲线如图甲所示。若将压强由p1增大到p2在图甲中画出p2的α(Fe3O4)~T 曲线示意图。___________ 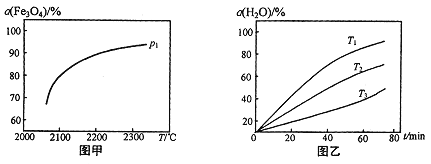 (2)已知H2的燃烧热是285.8kJ/mol,则液态水通过过程II转化的热化学方程式为______。 (3)其他条件不变时,过程II在不同温度下,H2O的转化率随时间的变化α(H2O)~t曲线如图乙所示,温度T1、T2、T3由大到小的关系是_________,判断依据是_________。 (4)科研人员研制出透氧膜(OTM),它允许电子和O2-同时透过,可实现水连续分解制H2,工作时CO、H2O分别在透氧膜的两侧反应。工作原理如图所示: 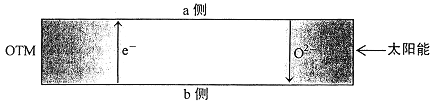 CO 在________侧反应(填“a”或“b”),另一侧的电极反应式为______________。 |
|
| 10. | 详细信息 |
|
氰化钠是一种剧毒物质,工业上常用硫代硫酸钠溶液处理废水中的氰化钠。硫代硫酸钠的工业制备原理为:2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 。某化学兴趣小组拟用该原理在实验室制备硫代硫酸钠,并检测氰化钠废水处理排放情况。 I.实验室通过如图所示装置制备Na2S2O3  (1)实验中要控制SO2生成速率,可采取的措施有_____________(写出一条)。 (2)b装置的作用是_____________ 。 (3)反应开始后,c 中先有淡黄色浑浊产生,后又变为澄清,此浑浊物为__________(填化学式)。 (4)实验结束后,在e处最好连接盛__________(填“NaOH 溶液”、“水”、“CCl4”中的一种) 的注射器,接下来的操作为______________,最后拆除装置。 II.氰化钠废水处理 (5)已知: a.废水中氰化钠的最高排放标准为0.50mg/L; b.Ag++2CN-==[Ag(CN)2]-,Ag++I-=AgI↓,AgI 呈黄色,且CN-优先与Ag+反应。 实验如下: 取20.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.00×10-4mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为1.50mL。 ①滴定时1.00×10-4mol/L的标准AgNO3溶液应用________(填仪器名称) 盛装; 滴定终点时的现象是______________。 ②处理后的废水是否达到排放标准_______(填“是”或“否”)。 |
|
| 11. | 详细信息 |
|
氮、磷及其化合物在工农业生产中都有重要作用。 (1)基态磷原子价电子排布的轨道表示式为___________。 (2) 元素B、N、O 的第一电离能由大到小的顺序为___________。 (3) 食品添加剂NaNO2中NO2-中心原子的杂化类型是_____,与NO2-互为等电子体的分子的化学式为___________。(写1种)。 (4)N2H4 是火箭的燃料,与氧气的相对分子质量相同,它在常温常压下是液态,而氧气是气态,造成这种差异的主要原因是____________。 (5)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。 ①三溴化磷分子的空间构型是_________,三溴化硼键角是___________。 ②磷化硼晶体晶胞如图所示: 其中实心球为磷原子,在一个晶胞中磷原子空间堆积方式为________,磷原子的配位数为___________,该结构中有一个配位键,提供空轨道的原子是___________。己知晶胞边长a pm,阿伏加德罗常数为NA。则磷化硼晶体的密度为___________g/cm3。  ③磷化硼晶胞沿着体对角线方向的投影(图中虚线圆圈表示P 原子的投影),用实线圆圈画出B 原子的投影位置(注意原子体积的相对大小)。______ |
|
| 12. | 详细信息 |
1923 年,在汉阳兵工厂工作的我国化学家吴蕴初先生研制出了廉价生产味精的方案,并于1926 年向英、美、法等化学工业发达国家申请专利。这也是历史上,中国的化学产品第一次在国外申请专利。以下是利用化学方法合成味精的路线: 请回答下列问题: (1)下列有关氨基酸的说法正确的是_______(填字母标号)。 A.氨基酸是组成蛋白质的基本结构单位 B.氨基酸都是α—氨基酸 C.氨基酸都有两性 D.氨基酸都难溶于水 (2)化合物I的化学名称为___________。 (3) F 中官能团的名称为__________;由B 生成C的反应类型___________。 (4) 写出由A 生成B 的化学方程式___________。 (5)符合下列要求的B的同分异构体共有20种。写出任意两种的结构简式为____________。 ①结构中含有六元环 ②能在NaOH溶液中发生水解反应 ③lmol 该物质与足量金属Na反应能够生成0.5molH2 (6)参照上述合成路线,写出以丙酸(CH3CH2COOH) 和甲醇为原料(其他无机试剂任选),合成丙氨酸( |
|
最近更新



