2019-2020е№ҙй«ҳдёҖдёҠеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲзҰҸе»әзңҒиҺҶ田第еҚҒдә”дёӯеӯҰпјү
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”өи§ЈйҘұе’ҢйЈҹзӣҗж°ҙеҲ¶еҸ–Cl2пјҢйҷӨеҫ—еҲ°Cl2еӨ–пјҢиҝҳиғҪеҫ—еҲ°зҡ„зү©иҙЁжҳҜ(гҖҖгҖҖ) A.H2е’ҢNaOH B.HClе’ҢHClO C.NaClOе’ҢNaCl D.Ca(ClO)2е’ҢCaCl2 |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
йҮ‘еұһй’ зқҖзҒ«ж—¶пјҢеҸҜд»ҘзҒӯзҒ«зҡ„зү©иҙЁжҳҜ( ) A.ж°ҙ B.жІҷеӯҗ C.з…ӨжІ№ D.жіЎжІ«зҒӯзҒ«еҷЁ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺж°Ҝж°”зҡ„еҸҷиҝ°пјҢдёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү A. ж°Ҝж°”жҳҜй»„з»ҝиүІпјҢжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“ B. ж°Ҝж°”гҖҒж¶Іж°Ҝе’Ңж°Ҝж°ҙжҳҜеҗҢдёҖз§Қзү©иҙЁ C. ж°Ҝж°”иғҪжә¶дәҺж°ҙ D. ж°Ҝж°”жҳҜдёҖз§ҚжңүжҜ’зҡ„ж°”дҪ“ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
ж°§еҢ–иҝҳеҺҹеҸҚеә”дёҺеӣӣз§Қеҹәжң¬зұ»еһӢеҸҚеә”зҡ„е…ізі»еҰӮеӣҫжүҖзӨәпјҢеҲҷдёӢеҲ—еҢ–еӯҰеҸҚеә”еұһдәҺйҳҙеҪұйғЁеҲҶзҡ„жҳҜ( ) A.Cl2пјӢ2KBr=Br2пјӢ2KCl B.2NaHCO3 C.4Fe(OH)2пјӢO2пјӢ2H2O=4Fe(OH)3 D.2Na2O2пјӢ2CO2=2Na2CO3пјӢO2 |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҢәеҲҶејәејұз”өи§ЈиҙЁзҡ„дҫқжҚ®жҳҜ( ) A.еҢ–еҗҲзү©ж°ҙжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣ B.еҢ–еҗҲзү©еңЁж°ҙдёӯзҡ„з”өзҰ»зЁӢеәҰ C.еҢ–еҗҲзү©еңЁж°ҙдёӯзҡ„жә¶и§ЈеәҰ D.еҢ–еҗҲзү©еңЁеёёжё©дёӢжҳҜдёҚжҳҜж°”дҪ“ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зӯүзү©иҙЁзҡ„йҮҸжө“еәҰзҡ„дёӢеҲ—жә¶ж¶ІдёӯпјҢеҜјз”өиғҪеҠӣжңҖејәзҡ„жҳҜпјҲ пјү A.зӣҗй…ё B.йҶӢй…ёжә¶ж¶І C.ж°Ёж°ҙ D.и”—зі–жә¶ж¶І |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ( ) A.еҮЎжҳҜејәз”өи§ЈиҙЁеңЁзҰ»еӯҗж–№зЁӢејҸдёӯйғҪиҰҒд»ҘзҰ»еӯҗзҡ„еҪўејҸжқҘиЎЁзӨә B.зҰ»еӯҗеҸҚеә”дёҖе®ҡдҪҝжә¶ж¶ІдёӯжүҖжңүзҰ»еӯҗзҡ„жө“еәҰйғҪеҸ‘з”ҹеҸҳеҢ– C.еӨҚеҲҶи§ЈеҸҚеә”еҝ…йЎ»е…·еӨҮзҰ»еӯҗеҸҚеә”зҡ„жҹҗдёӘжқЎд»¶ D.й…ёзўұдёӯе’ҢеҸҚеә”йғҪиғҪз”ЁзҰ»еӯҗж–№зЁӢејҸпјҡHпјӢпјӢOH-=H2OиЎЁзӨә |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
й»„зЈ·(P4)дёҺжө“ж°ўж°§еҢ–й’ҫеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёәпјҡP4 + 3KOH + 3H2O A.1вҲ¶2 B.2вҲ¶1 C.3вҲ¶1 D.1вҲ¶3 |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
йүҙеҲ«Na2CO3е’ҢNaHCO3жә¶ж¶ІпјҢдёҚеҸҜз”Ёзҡ„ж–№жі•жҳҜ( ) A.йҖҗж»ҙж»ҙеҠ зӣҗй…ё B.еҠ е…Ҙж°ҜеҢ–й’ҷжә¶ж¶І C.еҠ е…Ҙж°ўж°§еҢ–й’Ўжә¶ж¶І D.pHиҜ•зәё |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зӯүиҙЁйҮҸзҡ„Na2CO3гҖҒNaHCO3дёҺи¶ійҮҸзӣҗй…ёдҪңз”ЁпјҢз¬ҰеҗҲдёӢеҲ—жғ…еҶөзҡ„жҳҜ( ) A.Na2CO3жҜ”NaHCO3еҸҚеә”йҖҹзҺҮеҝ« B.зӣёеҗҢжқЎд»¶дёӢNa2CO3дә§з”ҹзҡ„CO2дҪ“з§ҜеӨ§ C.Na2CO3жҜ”NaHCO3еҸҚеә”еү§зғҲ D.NaHCO3ж”ҫеҮәзҡ„CO2еӨҡ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е°‘йҮҸзҡ„йҮ‘еұһй’ й•ҝжңҹжҡҙйңІеңЁз©әж°”дёӯпјҢе®ғзҡ„жңҖз»Ҳдә§зү©жҳҜпјҲ пјү A. NaOH B. Na2CO3вҖў10H2O C. Na2CO3 D. NaHCO3 |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
Na2CO3дҝ—еҗҚзәҜзўұпјҢдёӢйқўжҳҜеҜ№зәҜзўұйҮҮз”ЁдёҚеҗҢеҲҶзұ»жі•зҡ„еҲҶзұ»пјҢдёҚжӯЈзЎ®зҡ„жҳҜ A.Na2CO3жҳҜзўұ B.Na2CO3жҳҜзӣҗ C.Na2CO3жҳҜй’ зӣҗ D.Na2CO3жҳҜзўій…ёзӣҗ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйҮ‘еұһй’ зҡ„еҸҷиҝ°дёӯпјҢиҜҙжі•жӯЈзЎ®зҡ„жҳҜ( ) A.йҮ‘еұһй’ еҸҜд»ҘдҝқеӯҳеңЁе°‘йҮҸж°ҙдёӯ B.й’ еңЁз©әж°”дёӯзҮғзғ§пјҢдә§зү©жҳҜNa2O C.й’ жҳҜ银зҷҪиүІйҮ‘еұһпјҢдҪҶйңІзҪ®еңЁз©әж°”дёӯдјҡеҸҳжҡ— D.й’ жҠ•е…ҘеҲ°CuSO4жә¶ж¶Ідёӯдјҡи§ӮеҜҹеҲ°й’ иЎЁйқўжһҗеҮәзәўиүІзҡ„й“ң |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶзҮғзқҖзҡ„й•ҒжқЎдјёе…ҘдёӢеҲ—ж°”дҪ“дёӯпјҢдёҚиғҪеҸ‘з”ҹеҸҚеә”зҡ„жҳҜ ( ) A.ж°Ҝж°” B.ж°§ж°” C.дәҢж°§еҢ–зўі D.ж°–ж°” |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҢ–еӯҰеҸҚеә”пјҢеңЁд»Һжө·ж°ҙдёӯжҸҗеҸ–й•Ғзҡ„иҝҮзЁӢдёӯдёҚдјҡж¶үеҸҠзҡ„жҳҜ( ) A. C. 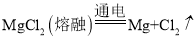 |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺй•Ғе’ҢдәҢж°§еҢ–зўізҡ„еҸҚеә”жҸҸиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A.MgOжҳҜиҝҳеҺҹдә§зү© B.1 mol CO2еҸӮеҠ еҸҚеә”пјҢе…ұиҪ¬з§»з”өеӯҗ4 mol C.й•ҒжҳҜиҝҳеҺҹеүӮ D.жӯӨе®һйӘҢзҺ°иұЎжҳҜй•ҒжқЎеү§зғҲзҮғзғ§пјҢеҸ‘еҮәиҖҖзңјзҡ„зҷҪе…үпјҢдә§з”ҹзҷҪиүІзІүжң«е’Ңй»‘иүІеӣәдҪ“ |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
иғҪз”ЁзҰ»еӯҗж–№зЁӢејҸH++OHвҖ”пјқH2OиЎЁзӨәзҡ„жҳҜ A. BaпјҲOHпјү2жә¶ж¶Іе’ҢH2SO4жә¶ж¶Іж··еҗҲ B. NaOHжә¶ж¶Іе’Ңзӣҗй…ёж··еҗҲ C. CuпјҲOHпјү2е’ҢзЁҖH2SO4еҸҚеә” D. CO2йҖҡе…ҘNaOHжә¶ж¶Ідёӯ |
|
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ‘зӣӣжңүзўҳеҢ–й’ҫжә¶ж¶Ізҡ„иҜ•з®ЎдёӯеҠ е…Ҙе°‘йҮҸж°Ҝж°ҙе’ҢCCl4еҗҺпјҢе……еҲҶжҢҜиҚЎпјҢеҸҜи§ӮеҜҹеҲ°ж¶ІдҪ“еҲҶеұӮпјҢе…¶дёӯ A.дёҠеұӮзҙ«иүІпјҢдёӢеұӮж— иүІ B.дёҠеұӮиҝ‘ж— иүІпјҢдёӢеұӮзҙ«иүІ C.дёҠеұӮиҝ‘ж— иүІпјҢдёӢеұӮжЈ•й»„иүІ D.дёҠеұӮй»„з»ҝиүІпјҢдёӢеұӮзҙ«иүІ |
|
| 19. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж— иүІйҖҸжҳҺжә¶ж¶ІеңЁзўұжҖ§жқЎд»¶дёӢиғҪеӨ§йҮҸе…ұеӯҳзҡ„зҰ»еӯҗз»„жҳҜ A.KпјӢгҖҒMnO C.NaпјӢгҖҒHпјӢгҖҒNO |
|
| 20. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁејәй…ёжҖ§жә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„ж— иүІйҖҸжҳҺзҰ»еӯҗз»„жҳҜпјҲ пјү A.K+гҖҒNa+гҖҒNO C.K+гҖҒNa+гҖҒBr-гҖҒCu2+ D.Na+гҖҒBa2+гҖҒOH-гҖҒSO |
|
| 21. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жЈҖйӘҢиҜ•ж ·дёӯжңүж— SO A.е…ҲеҠ зӣҗй…ёж— жҳҺжҳҫзҺ°иұЎпјҢеҶҚеҠ BaCl2жә¶ж¶ІжңүзҷҪиүІжІүж·ҖпјҢдёҖе®ҡжңүSO B.еҠ зӣҗй…ёй…ёеҢ–зҡ„BaCl2жә¶ж¶ІжңүзҷҪиүІжІүж·ҖпјҢдёҖе®ҡжңүSO C.ж»ҙеҠ зЎқй…ёй…ёеҢ–зҡ„AgNO3жә¶ж¶ІжІЎжңүзҷҪиүІжІүж·ҖпјҢдёҖе®ҡжІЎжңүSO D.ж»ҙеҠ BaCl2жңүзҷҪиүІжІүж·ҖпјҢдёҖе®ҡжңүSO |
|
| 22. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
йЈҹзӣҗе’ҢжіҘжІҷгҖҒйЈҹзӣҗе’ҢзЎқй…ёй’ҫгҖҒж°ҙе’Ңй…’зІҫгҖҒCCl4е’Ңж°ҜеҢ–й’ жә¶ж¶ІпјҢеҲҶзҰ»д»ҘдёҠеҗ„з»„ж··еҗҲзү©дёӯзҡ„дёӨз§Қзү©иҙЁзҡ„жӯЈзЎ®ж–№жі•дҫқж¬ЎжҳҜ( ) A.з»“жҷ¶гҖҒиҝҮж»ӨгҖҒеҲҶж¶ІгҖҒи’ёйҰҸ B.иҝҮж»ӨгҖҒз»“жҷ¶гҖҒи’ёйҰҸгҖҒеҲҶж¶І C.иҝҮж»ӨгҖҒз»“жҷ¶гҖҒеҲҶж¶ІгҖҒи’ёйҰҸ D.иҝҮж»ӨгҖҒз»“жҷ¶гҖҒеҲҶж¶ІгҖҒиҗғеҸ– |
|
| 23. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
| зҺ°жңүдёӢеҲ—зү©иҙЁпјҡв‘ CH3COOH в‘ЎNaOH в‘ўSO2 в‘ЈFe в‘ӨзҶ”иһҚKCl в‘ҘзҹізҒ°ж°ҙ в‘ҰзЁҖзЎ«й…ёгҖҖ⑧д№ҷйҶҮ в‘ЁNH3е…¶дёӯпјҢ еұһдәҺз”өи§ЈиҙЁзҡ„жҳҜ___________пјҢеұһдәҺйқһз”өи§ЈиҙЁзҡ„жҳҜ___________пјҢиғҪеҜјз”өзҡ„жҳҜ_____________пјӣ | |
| 24. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҶҷеҮәдёӢеҲ—зү©иҙЁеңЁж°ҙжә¶ж¶Ідёӯзҡ„з”өзҰ»ж–№зЁӢејҸгҖӮ Na2CO3пјҡ_______________________ CH3COOH:________________________ пјӣ NH4Clпјҡ_________________________ H2SO4пјҡ__________________________пјӣ H2CO3:__________________________пјӣ |
|
| 25. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҲҶжһҗдёӢеҲ—ж°§еҢ–иҝҳеҺҹеҸҚеә”пјҢжҢҮеҮәж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮгҖӮ Cl2+2KBr = Br2+2KCl ж°§еҢ–еүӮпјҡ______________пјӣиҝҳеҺҹеүӮпјҡ______________пјӣ 3NO2+H2O =2HNO3+NO ж°§еҢ–еүӮпјҡ_____________пјӣ иҝҳеҺҹеүӮпјҡ_____________пјӣ ж ҮеҮәиҜҘеҢ–еӯҰеҸҚеә”ж–№зЁӢејҸзҡ„еҸҢзәҝжЎҘпјҡ___________ 4Zn + 10HNO3 = 4Zn(NO3)2 + N2O + 5H2O |
|
| 26. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёӢеҲ—еҢ–еӯҰж–№зЁӢејҸж”№еҶҷжҲҗзҰ»еӯҗж–№зЁӢејҸгҖӮ (1)CaCO3пјӢ2HClпјқ CaCl2пјӢH2OпјӢCO2вҶ‘___________пјӣ (2)Cl2пјӢ2KIпјқ2KClпјӢI2___________пјӣ (3)FeпјӢ2HClпјқFeCl2пјӢH2вҶ‘___________пјӣ |
|
| 27. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”Ё18.4 molВ·LпјҚ1зҡ„жө“зЎ«й…ёпјҢй…ҚеҲ¶100 mL 1.0 molВ·LпјҚ1зҡ„зЁҖзЎ«й…ёпјҢиҜ·еӣһзӯ”д»ҘдёӢй—®йўҳпјҡ (1)йңҖиҰҒ18.4 molВ·LпјҚ1зҡ„жө“зЎ«й…ё__________ mLпјӣ (2)й…ҚеҲ¶ж—¶дёҚйңҖиҰҒз”ЁеҲ°зҡ„д»ӘеҷЁжңү__________(еЎ«д»ӘеҷЁзҡ„ж ҮеҸ·)пјӣ AпјҺжүҳзӣҳеӨ©е№ігҖҖBпјҺзғ§жқҜгҖҖCпјҺйҮҸзӯ’гҖҖDпјҺзғ§з“¶гҖҖEпјҺ250 mLе®№йҮҸ瓶гҖҖFпјҺ100 mLе®№йҮҸ瓶гҖҖGпјҺиғ¶еӨҙж»ҙз®ЎгҖҖHпјҺй“Ғжһ¶еҸ°(еёҰй“ҒеӨ№)гҖҖIпјҺзҺ»з’ғжЈ’ (3)дёӢеҲ—е®һйӘҢжӯҘйӘӨдёӯпјҢжӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸеә”иҜҘжҳҜ__________гҖӮ AпјҺз”ЁйҮҸзӯ’йҮҸеҸ–жө“зЎ«й…ёеҗҺпјҢзј“зј“еҖ’е…ҘиЈ…жңүзәҰ50 mL и’ёйҰҸж°ҙзҡ„зғ§жқҜйҮҢпјҢ并用зҺ»з’ғжЈ’жҗ…жӢҢ BпјҺз”ЁзәҰ30 mLи’ёйҰҸж°ҙпјҢеҲҶдёүж¬Ўжҙ—ж¶Өзғ§жқҜе’ҢзҺ»з’ғжЈ’пјҢе°ҶжҜҸж¬Ўзҡ„жҙ—ж¶Өж¶ІйғҪеҖ’е…Ҙе®№йҮҸ瓶дёӯ CпјҺе°ҶзЁҖйҮҠеҗҺзҡ„зЎ«й…ёе°Ҹеҝғең°еҖ’е…Ҙе®№йҮҸ瓶дёӯ DпјҺжЈҖжҹҘ100 mLе®№йҮҸ瓶瓶еҸЈжҳҜеҗҰжңүжјҸж¶ІзҺ°иұЎ EпјҺе°Ҷи’ёйҰҸж°ҙзӣҙжҺҘеҠ е…Ҙе®№йҮҸ瓶пјҢиҮіж¶ІйқўжҺҘиҝ‘еҲ»еәҰзәҝ1пҪһ2 cmеӨ„ FпјҺзӣ–зҙ§з“¶еЎһпјҢеҸҚеӨҚйў еҖ’жҢҜиҚЎпјҢж‘ҮеҢҖжә¶ж¶І GпјҺз”Ёиғ¶еӨҙж»ҙз®Ўеҗ‘е®№йҮҸ瓶йҮҢйҖҗж»ҙеҠ е…Ҙи’ёйҰҸж°ҙпјҢиҮіж¶ІйқўжңҖдҪҺзӮ№дёҺеҲ»еәҰзәҝзӣёеҲҮ (4)иҝӣиЎҢAжӯҘж“ҚдҪңзҡ„ж—¶еҖҷпјҢеә”иҜҘйҖүз”Ё__________mLйҮҸзӯ’гҖӮеҰӮжһңеҜ№иЈ…жңүжө“зЎ«й…ёзҡ„йҮҸзӯ’иҜ»ж•°еҰӮеӣҫжүҖзӨәпјҢй…ҚеҲ¶зҡ„зЁҖзЎ«й…ёзҡ„жө“еәҰе°Ҷ__________(еЎ«вҖңеҒҸй«ҳвҖқвҖңеҒҸдҪҺвҖқжҲ–вҖңж— еҪұе“ҚвҖқ)гҖӮ  (5)иҝӣиЎҢAжӯҘж“ҚдҪңеҗҺпјҢеҝ…йЎ»_________еҗҺпјҢжүҚиғҪиҝӣиЎҢCжӯҘж“ҚдҪңгҖӮ |
|
| 28. | иҜҰз»ҶдҝЎжҒҜ |
AгҖҒBгҖҒCгҖҒDгҖҒEгҖҒFгҖҒG гҖҒHгҖҒMд№қз§Қзү©иҙЁпјҢе…¶дёӯAгҖҒBгҖҒCеқҮдёәж°§еҢ–зү©пјҢдё”Aдёәж·Ўй»„иүІзІүжң«пјҢGгҖҒEдёәж°”дҪ“еҚ•иҙЁпјҢFзҡ„ж°ҙжә¶ж¶ІдёҺзҹізҒ°ж°ҙж··еҗҲеҸҜеҲ¶еҫ—Dзҡ„жә¶ж¶Іе®ғ们д№Ӣй—ҙзӣёдә’иҪ¬еҢ–е…ізі»еҰӮеӣҫпјҢе…¶д»–дёҺйўҳж— е…ізҡ„з”ҹжҲҗзү©еқҮе·Із•ҘеҺ»гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ (1)еҶҷеҮәеҢ–еӯҰејҸпјҡH___________пјҢC___________пјҢ (2)еҶҷеҮәдёӢеҲ—еҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ A + CвҶ’F + E___________гҖӮ F + Ca(OH)2вҶ’D___________гҖӮ (3)еҶҷеҮәAзҡ„дёҖз§Қз”ЁйҖ” ___________гҖӮ |
|
| 29. и®Ўз®—йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёәжөӢе®ҡжҹҗNaOHжә¶ж¶Ізҡ„жө“еәҰпјҢеҸ–40.0mLеҫ…жөӢж¶ІпјҢеҗ‘е…¶дёӯеҠ е…ҘиҝҮйҮҸзҡ„CuSO4жә¶ж¶ІпјҢе……еҲҶеҸҚеә”еҗҺиҝҮж»Ө并干зҮҘпјҢеҫ—еҲ°и“қиүІCu(OH)2жІүж·Җ1.96gгҖӮй—®пјҡ (1)иҜҘNaOHжә¶ж¶Ізҡ„жө“еәҰжҳҜеӨҡе°‘________пјҹ (2)еҸҚеә”з”ҹжҲҗзЎ«й…ёй’ зҡ„иҙЁйҮҸеӨҡе°‘е…Ӣ________пјҹ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- 2019еұҠй«ҳдёүдёҠеҚҠжңҹ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·пјҲж–°з–Ҷз»ҙеҗҫе°”иҮӘжІ»еҢәе…өеӣўз¬¬дәҢеёҲеҚҺеұұдёӯеӯҰпјү
- й«ҳдёҖеҢ–еӯҰдёӢеҶҢиҜҫж—¶з»ғд№ йўҳе…Қиҙ№иҜ•еҚ·
- 2019еұҠй«ҳдёүдәҢиҜҠжЁЎжӢҹзҗҶз»ј-еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲеӣӣе·қзңҒжіёеҺҝ第еӣӣдёӯеӯҰпјү
- еҗүжһ—2020е№ҙй«ҳдәҢдёӢеҚҠжңҹеҢ–еӯҰжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- 2018иҮі2019е№ҙй«ҳдёҖдёӢеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰдё“йўҳи®ӯз»ғпјҲжұҹиӢҸзңҒзӣҗеҹҺеёӮпјү
- еҶ…и’ҷеҸӨ第дёҖжңәжў°еҲ¶йҖ жңүйҷҗе…¬еҸёз¬¬дёҖдёӯеӯҰ2020еұҠй«ҳдёүеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·е®Ңж•ҙзүҲ
- еұұдёңзңҒжҪҚеқҠеёӮ2021еұҠй«ҳдёүеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰйўҳе…Қиҙ№еңЁзәҝжЈҖжөӢ
- й«ҳдёӯеҝ…еҲ·йўҳй«ҳдәҢйҖүжӢ©жҖ§еҝ…дҝ®1第дәҢз« еҢ–еӯҰеҸҚеә”йҖҹзҺҮдёҺеҢ–еӯҰе№іиЎЎ 第дәҢиҠӮ еҢ–еӯҰе№іиЎЎ иҜҫж—¶1 еҢ–еӯҰе№іиЎЎзҠ¶жҖҒ
жңҖиҝ‘жӣҙж–°



