2019届初三前半期期末化学考题(山东省临沂市蒙阴县)
| 1. 选择题 | 详细信息 |
|
下列变化属于化学变化的是( ) A. 湿衣晾干 B. 葡萄酿酒 C. 石头雕刻 D. 蜡烛熔化 |
|
| 2. 选择题 | 详细信息 |
|
下列各组物质中,前者是混合物,后者是氧化物的是( ) A. 空气、高锰酸钾 B. 河水、纯净的自来水 C. 纯净的自来水、五氧化二磷 D. 过氧化氢、二氧化碳 |
|
| 3. 选择题 | 详细信息 |
下列实验操作正确的是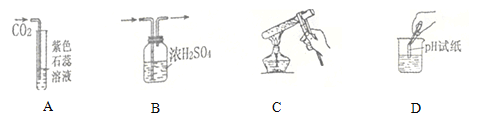 A. 检验CO2 B. 干燥H2 C. 加热试管里的液体 D. 检测待测溶液的pH |
|
| 4. 选择题 | 详细信息 |
|
分析推理是一种重要的化学思维方法,以下推理正确的是 A. 置换反应有单质和化合物生成、则有有单质和化合物生成的反应都是置换反应 B. 单质中只含有一种元素,则只含有一种元素的物质一定是单质 C. 点燃可燃性气体前要验纯,所以点燃H2前一定要验纯 D. 催化剂在化学反应前后质量不变,因此反应前后质量不变的物质都是催化剂 |
|
| 5. 选择题 | 详细信息 | |||||||||||||||
对生活中下列现象的解释错误的是( )
|
||||||||||||||||
| 6. 选择题 | 详细信息 |
|
生活中常接触到的“加铁酱油”“含氟牙膏”中的铁、氟是指 ( ) A. 单质 B. 元素 C. 原子 D. 分子 |
|
| 7. 选择题 | 详细信息 |
|
属于分解反应的是 A.Fe + CuSO4→FeSO4 + Cu B.2H2O2 C.CaO + H2O →Ca(OH)2 D.NaOH + HCl→NaCl + H2O |
|
| 8. 选择题 | 详细信息 |
如图所示,甲是溴(Br)的原子结构示意图,乙摘自元素周期表。下列说法正确的是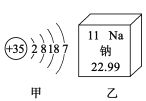 A. 甲元素属于金属元素 B. 甲、乙两种元素形成化合物的化学式是NaBr C. 乙原子的核内中子数为11 D. 甲原子核外共有5个电子层 |
|
| 9. 选择题 | 详细信息 |
|
银杏果中含有银杏酸(银杏酸化学式为C22H34O3),下列有关银杏酸说法正确的是 A. 从宏观上看:银杏酸分子由碳、氢、氧三种元素组成 B. 从微观上看:银杏酸由22个碳原子、34个氢原子和3个氧原子构成 C. 从类别上看:银杏酸属于有机化合物 D. 从质量上看:银杏酸中碳元素和氢元素的质量比为11:17 |
|
| 10. 选择题 | 详细信息 |
甲、乙、丙三种物质的溶解度曲线如图所示。下列说法错误的是( )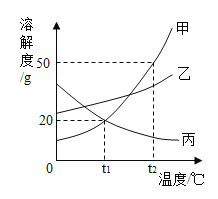 A. t1℃时,甲、乙、丙三种物质的溶解度由大到小的顺序是:乙>甲=丙 B. t2℃时,30g甲物质加入50g水中,充分搅拌后,所得溶液的溶质的质量分数为37.5% C. 将相同质量的甲、乙、丙三种物质的饱和溶液从t2℃降温到t1℃,析出晶体最多的是甲 D. 欲将丙物质的不饱和溶液变为饱和溶液,可以采取升高温度的方法 |
|
| 11. 选择题 | 详细信息 |
|
硒元素具有抗衰老、抑制癌细胞生长的功能。在硒的一种化合物硒酸钠(Na2SeO4)中,硒元素的化合价是 A. -3 B. +6 C. +4 D. +7 |
|
| 12. 选择题 | 详细信息 |
|
下图是两种气体发生化学反应的微观示意图,其中“●”表示氮原子,“○”表示氧原子。下列叙述正确的是( ): A. 生成物一定是混合物 B. 反应物的质量比为1:1 C. 该反应属于化合反应 D. 反应前后元素发生了变化 |
|
| 13. 选择题 | 详细信息 | |||||||||||||||
在一个密闭容器中放入甲、乙、丙、丁四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是( )
|
||||||||||||||||
| 14. 选择题 | 详细信息 |
|
净化水的方法有:①过滤②加絮凝剂沉降③蒸馏④消毒杀菌⑤煮沸。要将混有泥沙的天然水净化成生活用的饮用水,应选用的方法和顺序为 A. ①②③④ B. ②①④⑤③ C. ②①④⑤ D. ②①⑤④ |
|
| 15. 选择题 | 详细信息 |
|
3月22日是“世界水日”,今年3月22-28日是第三十一届“中国水周”,珍惜水资源已经成为人们的共识。下列有关水的叙述正确的是() A. 受热蒸发时水分子的体积逐渐变大,水由液态变为气态 B. 降温结冰时水分子静止不动,水的物理性质发生了变化 C. 参与光合作用的化学方程式为6CO2+6H2O D. 电解生成氢气和氧气,说明反应时水分子中的原子种类发生了变化 |
|
| 16. 选择题 | 详细信息 |
|
向一定量的硝酸铜、硝酸银的混合溶液中加入5.6 g铁粉,充分反应后过滤、洗涤、干燥,称得固体14 g。向固体中加入稀盐酸,无气泡产生,则下列分析正确的是( ) A. 滤液中一定不含有硝酸银 B. 滤液中一定含有硝酸铜 C. 滤出的固体中含有银7.6g D. 滤出的固体中含有铜6.4g |
|
| 17. 选择题 | 详细信息 |
|
某同学为验证铁、铜、银三种金属的活动性顺序,他设计了以下四种实验方案,其中能达到目的是 A. 将Fe、Cu分别加入AgNO3溶液中 B. 将Fe、Cu、Ag分别加入稀盐酸中 C. 将Fe分别加入CuSO4、AgNO3溶液中 D. 将Fe、Ag分别加入CuSO4溶液中 |
|
| 18. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列物质中的少量杂质,下列选用试剂或方法正确的是( )
|
|||||||||||||||||||||
| 19. 填空题 | 详细信息 |
| 空气中体积分数占21%的气体是_____;它与地壳中含量最多的金属元素形成的化合物的化学式_____。 | |
| 20. 填空题 | 详细信息 |
| 硬水为生产和生活带来一些麻烦,可用_____区分硬水和软水.高铁酸钾(K2FeO4)是一种新型高效多功能水处理剂,其中铁元素的化合价是_____.日常生活中烧开水时,水壶内常常有一些水垢(主要成分之一是碳酸钙),用稀盐酸可以除去水垢,写出除去水垢的化学方程式_____. | |
| 21. 流程题 | 详细信息 |
(1)向水样中加入明矾搅拌溶解,静置一段时间后,进行操作①的名称是_____;该操作中用到玻璃仪器有_____(任写一个),若进行完该操作后,发现滤液仍旧浑浊,造成这一现象的因可能是_____(写一个原因)。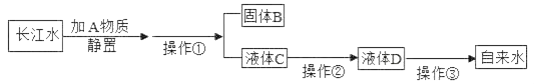 (2)操作②主要是除去一些异味和色素,应选用的物质是_____,操作③是消毒杀菌,这过程主要是_____变化。 (3)自来水厂用二氧化氯消毒杀菌,二氧化氯的化学式为_____,其中氯元素的化合价为_____。 为降低硬度,日常生活中使用硬水会带来许多麻烦,家庭生活中常用来降低水硬度的方法是_____。 |
|
| 22. 填空题 | 详细信息 |
|
实验是进行科学探究的重要手段。请回答下列问题。 (1)电解水试验发生反应的化学方程式是_____,当电源接通一段时间后,a 管(与正极相连)与 b 管(与负极相连)中气体的体积比约为_____。 (2)排水法收集氧气的试验集气瓶内装满水的目的是_____。 (3)测定空气中氧气的含量的实验通过_____现象,可得出氧气约占空气体积 (4)铁丝在氧气中燃烧试验中集气瓶底部水的作用是_____。 |
|
| 23. 填空题 | 详细信息 |
|
生活中处处有化学。请用下列物质的序号填空: ①氮气②氢气③氯气④明矾⑤小苏打⑥烧碱 (1)用于自来水杀菌消毒的是_____; (2)填充探空气球的理想气体是_____; (3)用于治疗胃酸过多的是_____。 |
|
| 24. 简答题 | 详细信息 |
下图是a、b、c三种固体物质的溶解度曲线图,请回答问题: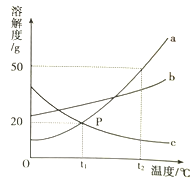 (1)t2℃时,a、b、c三种物质中,溶解度由大到小的顺序是_____________。 (2)将c物质的不饱和溶液转变成饱和溶液可采取的方法有_____________。(写出一种即可)。 (3) t2℃时,将30ga物质加入50g水中充分溶解后,所得溶液的质量是_____g. (4)图中P点所表示的意义是______。 |
|
| 25. 填空题 | 详细信息 |
随着科学的发展,新能源的开发不断取得突破。清华大学研究人员成功研制出一种纳米纤维催化剂,可将二氧化碳转化成液体燃料甲醇,其微观示意图如图(图中的微粒恰 好完全反应)所示。请根据微观示意图回答以下问题。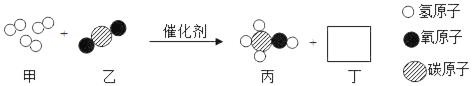 (1)丁的化学式为_____,该反应的化学方程式为_____。 (2)下列说法正确的是_____(填写字母序号)。 A.反应前后原子数目发生改变 B.该反应属于置换反应 C.甲是单质,乙、丙、丁均为化合物 D.该化学反应前原子种类不变 |
|
| 26. 填空题 | 详细信息 |
|
二氧化碳和一氧化碳虽只有一字之差,但它们化学性质相差很大。 (1)有人认为,二者就像孪生姐妹,这是因为_____(填序号); A.它们由同种分子构成 B.它们由相同的元素组成 C.它们都能与氧气反应 (2)二氧化碳能与水反应,一氧化碳难溶于水,写出二氧化碳与水反应的化学方程式_____; (3)过多的二氧化碳加剧了“温室效应”,写出一条控制二氧化碳排放的措施_____。 (4)区别一氧化碳和二氧化碳的方法_____;(填写具体操作方法、现象与结论,下同。) a:_____; b:_____。 |
|
| 27. 实验探究题 | 详细信息 |
实验室利用如图所示装置进行相关实验,请回答问题。 ④ ④(1)写出装置图中标号a仪器的名称_____。 (2)用高锰酸钾制取氧气,选用的发生装置是_____(填字母),反应的化学方程式为_____。 (3)实验室里用锌粒和稀硫酸反应制取氢气,若要控制反应的发生和停止,应选用的发生装置是_____(填字母)。 |
|
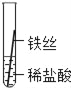
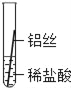
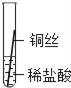
| 28. 科学探究题 | 详细信息 | ||||||||||||
|
铁、铝、铜是常见的三种金属。生活中的铝制品和铜器表面一般不用防锈,而铁制品则需防锈处理。 (提出问题)这三种金属的活动性强弱到底如何呢? (实验探究)同学们将粗细相同的铁丝、铝丝、铜丝分别插入等体积、等浓度的稀盐酸溶液中:
|
|||||||||||||
| 29. 计算题 | 详细信息 | |||||||||||||||
某兴趣小组对石灰石样品进行如下实验取12g样品放入烧杯中,将100g稀盐酸分4次加入到烧杯中,充分反应后(杂质不溶于水,也不与酸反应),测得剩余固体的质量记录如下。请计算:
|
||||||||||||||||