еҜҝе…үеёӮ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғжөӢйӘҢиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
е…ідәҺдёӢеҲ—еӣӣдёӘиЈ…зҪ®еӣҫзҡ„иҜҙжі•пјҢжӯЈзЎ®зҡ„жҳҜ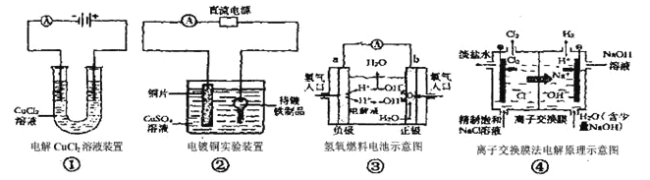 AпјҺв‘ иЈ…зҪ®дёӯйҳҙжһҒеӨ„дә§з”ҹзҡ„ж°”дҪ“иғҪдҪҝж№ҝж¶Ұзҡ„ж·ҖзІүKIиҜ•зәёеҸҳи“қ BпјҺв‘ЎиЈ…зҪ®дёӯеҫ…й•Җзҡ„й“ҒеҲ¶е“Ғеә”дёҺз”өжәҗжӯЈжһҒзӣёиҝһ CпјҺв‘ўиЈ…зҪ®дёӯз”өеӯҗз”ұbжһҒз»ҸеҜјзәҝжөҒеҗ‘aжһҒ DпјҺв‘ЈиЈ…зҪ®дёӯзҡ„зҰ»еӯҗдәӨжҚўиҶңеҸҜд»ҘйҒҝе…Қз”ҹжҲҗзҡ„Cl2дёҺNaOHжә¶ж¶ІеҸҚеә” |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҳҜжҹҗеӯҰз”ҹиҮӘе·ұжҖ»з»“зҡ„дёҖдәӣ规еҫӢпјҢе…¶дёӯжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ) A. ж°§еҢ–зү©дёҚеҸҜиғҪжҳҜиҝҳеҺҹдә§зү©пјҢеҸӘеҸҜиғҪжҳҜж°§еҢ–дә§зү© B. дёҖз§Қе…ғзҙ еҸҜиғҪжңүеӨҡз§Қж°§еҢ–зү©пјҢдҪҶеҗҢз§ҚеҢ–еҗҲд»·еҸӘеҜ№еә”дёҖз§Қж°§еҢ–зү© C. йҘұе’Ңжә¶ж¶ІдёҖе®ҡжҜ”дёҚйҘұе’Ңжә¶ж¶Ізҡ„жө“еәҰеӨ§ D. жңүдәӣеҢ–еӯҰеҸҚеә”дёҚеұһдәҺеҢ–еҗҲгҖҒеҲҶи§ЈгҖҒзҪ®жҚўгҖҒеӨҚеҲҶи§Јзӯүзұ»еһӢдёӯзҡ„д»»дҪ•дёҖз§Қ |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дёҺеҢ–еӯҰеҸҚеә”иғҪйҮҸеҸҳеҢ–зӣёе…ізҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.з”ҹжҲҗзү©жҖ»иғҪйҮҸдёҖе®ҡдҪҺдәҺеҸҚеә”зү©жҖ»иғҪйҮҸ B.ж”ҫзғӯеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮжҖ»жҳҜеӨ§дәҺеҗёзғӯеҸҚеә”зҡ„еҸҚеә”йҖҹзҺҮ C.еә”з”Ёзӣ–ж–Ҝе®ҡеҫӢпјҢеҸҜи®Ўз®—жҹҗдәӣйҡҫд»ҘзӣҙжҺҘжөӢйҮҸзҡ„еҸҚеә”з„“еҸҳ D.еҗҢжё©еҗҢеҺӢдёӢпјҢH2(g)+Cl2(g)=2HClеңЁе…үз…§е’ҢзӮ№зҮғжқЎд»¶дёӢзҡ„в–іHдёҚеҗҢ |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
25в„ғж—¶пјҢз”ІгҖҒд№ҷдёӨзғ§жқҜеҲҶеҲ«зӣӣжңү5mLpHпјқ1зҡ„зӣҗй…ёе’ҢзЎ«й…ёпјҢдёӢеҲ—жҸҸиҝ°дёӯдёҚжӯЈзЎ®зҡ„жҳҜ A. зү©иҙЁзҡ„йҮҸжө“еәҰпјҡcз”І=2cд№ҷ B. ж°ҙз”өзҰ»еҮәзҡ„OHпјҚжө“еәҰпјҡc(OHпјҚ)з”Іпјқc(OHпјҚ)д№ҷ C. иӢҘеҲҶеҲ«з”Ёзӯүжө“еәҰзҡ„NaOHжә¶ж¶Іе®Ңе…Ёдёӯе’ҢпјҢжүҖеҫ—жә¶ж¶Ізҡ„pHпјҡз”І=д№ҷ D. е°Ҷз”ІгҖҒд№ҷзғ§жқҜдёӯжә¶ж¶Іж··еҗҲеҗҺпјҲдёҚиҖғиҷ‘дҪ“з§ҜеҸҳеҢ–пјүпјҢжүҖеҫ—жә¶ж¶Ізҡ„pHпјһ1 |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүжңәеҸҚеә”пјҡв‘ з”Ізғ·дёҺж°Ҝж°”е…үз…§еҸҚеә” в‘Ўд№ҷйҶӣеҲ¶д№ҷй…ё в‘ўд№ҷзғҜдҪҝжәҙж°ҙиӨӘиүІ в‘Јд№ҷйҶҮеҲ¶д№ҷзғҜ в‘Өд№ҷйҶӣеҲ¶д№ҷйҶҮ в‘Ҙд№ҷй…ёеҲ¶д№ҷй…ёд№ҷй…Ҝ в‘Ұд№ҷй…ёд№ҷй…ҜдёҺNaOHжә¶ж¶Іе…ұзғӯ ⑧液жҖҒжӨҚзү©жІ№еҲ¶дәәйҖ и„ӮиӮӘ в‘Ёд№ҷзғҜеҲ¶д№ҷйҶҮзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. в‘Ўв‘Өзҡ„еҸҚеә”зұ»еһӢзӣёеҗҢ B. в‘Ҙв‘Ұзҡ„еҸҚеә”зұ»еһӢдёҚеҗҢ C. в‘ЈдёҺе…¶д»–8дёӘеҸҚеә”зҡ„зұ»еһӢйғҪдёҚеҗҢ D. ①③⑧еұһдәҺеҗҢдёҖз§ҚеҸҚеә”зұ»еһӢ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
иҝӣиЎҢеҢ–еӯҰе®һйӘҢж—¶еҝ…йЎ»иҰҒжңүе®үе…Ёж„ҸиҜҶпјҢдёӢеҲ—еҒҡжі•й”ҷиҜҜзҡ„жҳҜ A. иў«зҺ»з’ғеүІдјӨжүӢеҗҺпјҢе…ҲеҸ–еҮәдјӨеҸЈйҮҢзҡ„зҺ»з’ғзүҮпјҢеҶҚз”ЁзЁҖиҝҮж°§еҢ–ж°ўжә¶ж¶Іж“Ұжҙ—пјҢ然еҗҺж•·иҚҜеҢ…жүҺ B. ж»ҙ瓶дёӯзҡ„ж»ҙз®Ўз”ЁеҗҺдёҚз”Ёжё…жҙ—пјҢзӣҙжҺҘж”ҫеҲ°ж»ҙ瓶дёӯ C. зӮ№зҮғж°ўж°”зӯүжҳ“зҮғжҖ§ж°”дҪ“еүҚпјҢеҝ…йЎ»жЈҖйӘҢж°”дҪ“зҡ„зәҜеәҰ D. жё©еәҰи®Ўж‘”еқҸеҜјиҮҙж°ҙ银散иҗҪеҲ°ең°йқўдёҠпјҢеә”з«ӢеҚіз”Ёж°ҙеҶІжҙ—ж°ҙ银 |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёӯпјҢдёҚжӯЈзЎ®зҡ„жҳҜ A. C6H14дёҺж¶ІжәҙеңЁе…үз…§дёӢдјҡеҸҚеә” B. зӣ®еүҚзҹіжІ№иЈӮи§ЈжҳҜз”ҹдә§д№ҷзғҜзҡ„дё»иҰҒж–№жі• C. иӢҜзҡ„з»“жһ„еҶіе®ҡдәҶиӢҜзҡ„еҢ–еӯҰжҖ§иҙЁжҳҜжҳ“еҸ–д»ЈйҡҫеҠ жҲҗ D. д№ҷзғҜгҖҒд№ҷзӮ”еҸҜйҖҡе…Ҙжәҙж°ҙеҠ д»ҘйүҙеҲ« |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ ( ) A. NaHSO4жә¶ж¶ІдёҺBa(OH)2жә¶ж¶Іж··иҲҚеҗҺе‘ҲдёӯжҖ§пјҡ2H++ SO42-+ Ba2++ 2OH- =BaSO4вҶ“+2H2O B. Ca( HCO3)2жә¶ж¶ІдёҺиҝҮйҮҸNaOHжә¶ж¶ІеҸҚеә”пјҡCa2++ HCO3-+OH- =CaCO3вҶ“+H2O C. Ca(ClO)2жә¶ж¶ІдёӯйҖҡе…Ҙе°‘йҮҸCO2пјҡ2C1O-+ CO2+H2O=2HC1O+ CO32- D. Fe(NO3)3жә¶ж¶ІдёӯеҠ е…ҘиҝҮйҮҸзҡ„HIжә¶ж¶ІпјҡFe3++ NO3-+4H++ 4I- =Fe2++ NOвҶ‘ +2I2+2H2O |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жңүе…іжңүжңәзү©жҖ§иҙЁзҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. иӣӢзҷҪиҙЁеҸҜд»ҘдёҺй…ёгҖҒзўұжҲ–йҮҚйҮ‘еұһзӣҗеҸҚеә” B. иҠійҰҷзғғйғҪдёҚиғҪдҪҝй…ёжҖ§KMnO4жә¶ж¶ІиӨӘиүІ C. CH3CH2OHдёҺж°ўжәҙй…ёдёҚиғҪеҸҚеә” D. зҹіжІ№зҡ„еҲҶйҰҸеҸҜиҺ·еҫ—д№ҷзғҜгҖҒдёҷзғҜзӯүдёҚйҘұе’Ңзғғ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁж— иүІжә¶ж¶ІдёӯпјҢдёӢеҲ—зҰ»еӯҗиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ A. Mg2+гҖҒSO42пјҚгҖҒK +гҖҒClпјҚ B. Na+ гҖҒNH4+ гҖҒNO3пјҚгҖҒMnO4пјҚ C. K + гҖҒCu2+ гҖҒClпјҚгҖҒBrпјҚ D. Ba2+ гҖҒNa+ гҖҒOHпјҚгҖҒHCO3пјҚ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
гҖҗйўҳзӣ®гҖ‘дёӢеҲ—жҸҸиҝ°дёӯжӯЈзЎ®зҡ„жҳҜ ( ) A. зәҜзўұжә¶дәҺзғӯж°ҙеҗҺеҺ»жұЎж•ҲжһңеўһејәпјҢиҜҙжҳҺзәҜзўұзҡ„ж°ҙи§ЈеҸҚеә”жҳҜеҗёзғӯеҸҚеә” B. NH3(g) + HCl(g) = NH4Cl(s) еңЁиҫғдҪҺжё©еәҰдёӢиғҪиҮӘеҸ‘иҝӣиЎҢпјҢиҜҙжҳҺиҜҘеҸҚеә”зҡ„О”H>0 C. 500в„ғгҖҒ30 MPaдёӢпјҢе°Ҷ7 g N2е’Ң3 g H2зҪ®дәҺеҜҶй—ӯе®№еҷЁдёӯе……еҲҶеҸҚеә”з”ҹжҲҗNH3(g)пјҢж”ҫзғӯ19.3 kJпјҢе…¶зғӯеҢ–еӯҰж–№зЁӢејҸдёәN2(g)пјӢ3H2(g) D. з”Ізғ·зҡ„зҮғзғ§зғӯпјҲО”HпјүдёәпјҚ890.3 kJВ·molпјҚ1пјҢеҲҷз”Ізғ·зҮғзғ§зҡ„зғӯеҢ–еӯҰж–№зЁӢејҸеҸҜиЎЁзӨәдёәCH4(g)пјӢ2O2(g)пјқ CO2(g)пјӢ2H2O(g)гҖҖО”HпјқпјҚ890.3 kJВ·molпјҚ1 |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жә¶ж¶Ідёӯжә¶иҙЁзҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә1mol/Lзҡ„жҳҜ A. е°Ҷ58.5g NaClжә¶и§ЈдәҺ1Lж°ҙдёӯ B. е°Ҷ22.4Lж°ҜеҢ–ж°ўж°”дҪ“жә¶дәҺж°ҙй…ҚжҲҗ1Lжә¶ж¶І C. е°Ҷ2L 5mol/Lзҡ„жө“зӣҗй…ёдёҺ8Lж°ҙж··еҗҲ D. зү№l0g NaOHжә¶и§ЈдәҺж°ҙдёӯй…ҚжҲҗ250mLжә¶ж¶І |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү A. pH=2зҡ„H2SO4дёҺpH=1зҡ„зЎқй…ёжә¶ж¶Ідёӯc(H+)д№ӢжҜ”дёә1:10 B. 0.2 molвҖўL-1дёҺ0.1 molвҖўL-1йҶӢй…ёдёӯc(H+)д№ӢжҜ”дёә2:1 C. 100в„ғж—¶пјҢзәҜж°ҙзҡ„pH=6пјҢжҳҫй…ёжҖ§ D. 100mLпјҢ pH=3зҡ„зӣҗй…ёе’ҢйҶӢй…ёжә¶ж¶ІпјҢеҲҶеҲ«дёҺи¶ійҮҸй”ҢеҸҚеә”еҗҺпјҢжүҖеҫ—H2зҡ„иҙЁйҮҸзӣёзӯү |
|
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
з”ІеҹәдёҷзғҜй…ёз”Ій…ҜжҳҜеҗҲжҲҗжңүжңәзҺ»з’ғзҡ„еҚ•дҪ“пјҢе…¶еҗҲжҲҗж–№жі•д№ӢдёҖеҰӮдёӢпјҡCH3OCвүЎCH+CH3OH+A A. е·ІзҹҘиҜҘеҸҚеә”зҡ„еҺҹеӯҗеҲ©з”ЁзҺҮдёә100%пјҢеҲҷAдёәCO2 B. CH3OHе’Ңз”ҳжІ№дә’дёәеҗҢзі»зү© C. CH3CвүЎCHдёҺдёҷзғҜзҡ„жҖ§иҙЁзӣёдјјпјҢеҲҷиҜҘзү©иҙЁеҸҜд»ҘеҸ‘з”ҹеҠ жҲҗгҖҒж°§еҢ–еҸҚеә” D. иғҪдёҺNaHCO3еҸҚеә”зҡ„CH2=C(CH3)COOCH3зҡ„еҗҢеҲҶејӮжһ„дҪ“жңү9з§Қ |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. еңЁзҙ«еӨ–зәҝгҖҒйҘұе’Ң(NH4)2SO4жә¶ж¶ІгҖҒCuSO4жә¶ж¶ІзӯүдҪңз”ЁдёӢпјҢиӣӢзҷҪиҙЁеқҮдјҡеҸ‘з”ҹеҸҳеҢ– B. дёәжЈҖйӘҢзҡӮеҢ–еҸҚеә”иҝӣиЎҢзЁӢеәҰпјҢеҸ–еҮ ж»ҙеҸҚеә”ж¶ІпјҢж»ҙе…ҘиЈ…жңүзғӯж°ҙзҡ„иҜ•з®ЎдёӯпјҢжҢҜиҚЎпјҢиӢҘжңүжІ№ж»ҙжө®еңЁж¶ІйқўдёҠпјҢиҜҙжҳҺжІ№и„Ӯе·Іе®Ңе…ЁеҸҚеә” C. еҸӘз”Ёж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶Іе°ұеҸҜд»ҘйүҙеҲ«д№ҷй…ёжә¶ж¶ІгҖҒи‘Ўиҗ„зі–жә¶ж¶ІгҖҒж·ҖзІүжә¶ж¶І D. иӢҜжҳҜд»Һз…ӨдёӯеҲҶзҰ»еҫ—еҲ°зҡ„дёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢжҳҜж— иүІгҖҒжңүзү№ж®Ҡж°”е‘ізҡ„ж¶ІжҖҒзғғ |
|
| 16. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. еңЁзҙ«еӨ–зәҝгҖҒйҘұе’Ң(NH4)2SO4жә¶ж¶ІгҖҒCuSO4жә¶ж¶ІзӯүдҪңз”ЁдёӢпјҢиӣӢзҷҪиҙЁеқҮдјҡеҸ‘з”ҹеҸҳеҢ– B. дёәжЈҖйӘҢзҡӮеҢ–еҸҚеә”иҝӣиЎҢзЁӢеәҰпјҢеҸ–еҮ ж»ҙеҸҚеә”ж¶ІпјҢж»ҙе…ҘиЈ…жңүзғӯж°ҙзҡ„иҜ•з®ЎдёӯпјҢжҢҜиҚЎпјҢиӢҘжңүжІ№ж»ҙжө®еңЁж¶ІйқўдёҠпјҢиҜҙжҳҺжІ№и„Ӯе·Іе®Ңе…ЁеҸҚеә” C. еҸӘз”Ёж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶Іе°ұеҸҜд»ҘйүҙеҲ«д№ҷй…ёжә¶ж¶ІгҖҒи‘Ўиҗ„зі–жә¶ж¶ІгҖҒж·ҖзІүжә¶ж¶І D. иӢҜжҳҜд»Һз…ӨдёӯеҲҶзҰ»еҫ—еҲ°зҡ„дёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢжҳҜж— иүІгҖҒжңүзү№ж®Ҡж°”е‘ізҡ„ж¶ІжҖҒзғғ гҖҗзӯ”жЎҲгҖ‘C гҖҗи§ЈжһҗгҖ‘ AпјҺйҘұе’Ң(NH4)2SO4жә¶ж¶ІеҸӘиғҪдҪҝиӣӢзҷҪиҙЁжә¶ж¶ІеҸ‘з”ҹзӣҗжһҗпјҢдёҚиғҪеҸҳжҖ§пјҢж•…Aй”ҷиҜҜпјӣ BпјҺжІ№и„ӮдёҚжә¶дәҺж°ҙдё”еҜҶеәҰжҜ”ж°ҙе°ҸпјҢжңӘж°ҙи§Јзҡ„жІ№и„Ӯдјҡжө®еңЁж°ҙйқўдёҠпјҢж•…Bй”ҷиҜҜпјӣ CпјҺд№ҷй…ёжә¶ж¶ІиғҪжә¶и§ЈCu(OH)2жӮ¬жөҠж¶ІпјҢи‘Ўиҗ„зі–жә¶ж¶ІдёҺж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶Іж··еҗҲеҠ зғӯпјҢеҸҜз”ҹжҲҗз –зәўиүІжІүж·ҖпјҢж·ҖзІүжә¶ж¶ІдёҺж–°еҲ¶Cu(OH)2жӮ¬жөҠж¶Іж— жҳҺжҳҫзҺ°иұЎпјҢеҸҜйүҙеҲ«пјҢж•…CжӯЈзЎ®пјӣ DпјҺз…Өзҡ„е№ІйҰҸеҸҜиҺ·еҫ—иӢҜпјҢдёҚжҳҜз®ҖеҚ•еҲҶзҰ»еҫ—еҲ°зҡ„пјҢз…ӨдёӯдёҚеҗ«жңүиӢҜпјҢж•…Dй”ҷиҜҜпјӣ зӯ”жЎҲдёәCгҖӮ гҖҗйўҳеһӢгҖ‘еҚ•йҖүйўҳ гҖҗз»“жқҹгҖ‘ 17 гҖҗйўҳзӣ®гҖ‘дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. и‘Ўиҗ„зі–еҲ¶й•ңеҲ©з”ЁдәҶи‘Ўиҗ„зі–зҡ„ж°§еҢ–жҖ§ B. е®Өжё©дёӢпјҢеңЁж°ҙдёӯзҡ„жә¶и§ЈеәҰпјҡд№ҷйҶҮ > иӢҜй…ҡ > д№ҷй…ёд№ҷй…Ҝ C. й…ҜеңЁзўұжҖ§жқЎд»¶дёӢж°ҙи§Јз”ҹжҲҗеҜ№еә”зҡ„й…ёе’ҢйҶҮ D. з”ІиӢҜиғҪдҪҝй…ёжҖ§й«ҳй”°й…ёй’ҫжә¶ж¶ІиӨӘиүІпјҢиҜҙжҳҺз”ІеҹәдҪҝиӢҜзҺҜеҸҳжҙ»жіј |
|
| 17. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
Fe2O3+3CO A. еҢ–еҗҲеҸҚеә” B. зҪ®жҚўеҸҚеә” C. ж°§еҢ–иҝҳеҺҹеҸҚеә” D. еӨҚеҲҶи§ЈеҸҚеә” |
|
| 18. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁдёҚиғҪе®һзҺ°зӣҙжҺҘиҪ¬еҢ–зҡ„жҳҜ(гҖҖгҖҖ) A. MgвҶ’MgOвҶ’MgCl2вҶ’Mg(OH)2 B. CuвҶ’CuCl2вҶ’Cu(NO3)2вҶ’Cu(OH)2 C. FeвҶ’Fe3O4вҶ’Fe(OH)3вҶ’Fe2O3 D. NaвҶ’Na2O2вҶ’Na2CO3вҶ’NaCl |
|
| 19. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
2016е№ҙ6жңҲ25ж—ҘпјҢжҲ‘еӣҪж–°дёҖд»ЈиҝҗиҪҪзҒ«з®ӯй•ҝеҫҒдёғеҸ·еңЁжө·еҚ—ж–ҮжҳҢеҸҚе°„жҲҗеҠҹгҖӮвҖңй•ҝеҫҒдёғеҸ·вҖқиҝҗиҪҪзҒ«з®ӯдҪҝз”Ёзҡ„жҳҜж¶Іж°§з…ӨжІ№жҺЁиҝӣеүӮпјҢдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲ пјү AпјҺе·ҘдёҡдёҠйҖҡиҝҮе°Ҷз©әж°”еҶ·еҮқжҲҗж¶ІдҪ“еҗҺеҶҚеҲҶзҰ»зҡ„ж–№ејҸиҺ·еҫ—ж¶Іж°§ BпјҺжҺЁиҝӣеүӮзҮғзғ§еҗҺзҡ„дё»иҰҒдә§зү©жҳҜж°ҙе’ҢдәҢж°§еҢ–зўі CпјҺз…ӨжІ№еұһдәҺзәҜеҮҖзү©пјҢдё»иҰҒжҲҗеҲҶжҳҜзғғ DпјҺж°§ж°”дёҺз…ӨжІ№зҡ„еҸҚеә”жҳҜж”ҫзғӯеҸҚеә” |
|
| 20. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
в‘ C(s) +1/2O2(g) пјқCO(g) вҲҶH1 =пјҚ110.5 kJВ·molвҲ’1 в‘Ў H2O(g) пјқ1/2O2(g) +H2(g) вҲҶH2 =пјӢ241.8 kJВ·molвҲ’1 в‘ў C(s) +H2O(g) пјқCO(g) +H2(g) вҲҶH3 иҜ·еӣһзӯ”пјҡ пјҲ1пјүеҸҚеә”в‘ еұһдәҺ______пјҲйҖүеЎ«вҖңеҗёзғӯвҖқжҲ–вҖңж”ҫзғӯвҖқпјүеҸҚеә”гҖӮ пјҲ2пјүеҸҚеә”в‘ ж¶ҲиҖ—12 g C(s)ж—¶пјҢвҲҶH =______kJВ·molвҲ’1гҖӮ пјҲ3пјүеҸҚеә”в‘Ўз”ҹжҲҗ1 mol H2(g)ж—¶пјҢвҲҶH = ______kJВ·molвҲ’1гҖӮ пјҲ4пјүеҸҚеә”в‘ўзҡ„вҲҶH3 =______kJВ·molвҲ’1гҖӮ |
|
| 21. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҢ–еҗҲзү©FжҳҜдёҖз§ҚжңҖж–°еҗҲжҲҗзҡ„жә¶зҳӨиҚҜзү©пјҢеҸҜйҖҡиҝҮд»ҘдёӢж–№жі•еҗҲжҲҗпјҡ в‘ҙDдёӯжүҖеҗ«е®ҳиғҪеӣўеҗҚз§°дёә________гҖӮ в‘өAвҶ’Bзҡ„еҸҚеә”зұ»еһӢжҳҜ________гҖӮ ⑶Bзҡ„еҲҶеӯҗејҸдёә________гҖӮ в‘·Cзҡ„з»“жһ„з®ҖејҸдёә________гҖӮ в‘ёAзҡ„ж ёзЈҒе…ұжҢҜж°ўи°ұжңү_______з§Қзұ»еһӢж°ўеҺҹеӯҗзҡ„еҗёж”¶еі°гҖӮ |
|
| 22. з»јеҗҲйўҳ | иҜҰз»ҶдҝЎжҒҜ | ||||||||
|
жҢүиҰҒжұӮе®ҢжҲҗдёӢеҲ—еҗ„е°Ҹйўҳ пјҲ1пјүеҶҷеҮәNaHSO4еңЁж°ҙжә¶ж¶Ідёӯзҡ„з”өзҰ»ж–№зЁӢејҸ______________________________________гҖӮ пјҲ2пјүж°ҜеҢ–й“қзҡ„ж°ҙжә¶ж¶Іеёёжё©ж—¶е‘Ҳ_____(еЎ«вҖңй…ёвҖқгҖҒвҖңдёӯвҖқгҖҒвҖңзўұвҖқ)жҖ§пјҢжҠҠж°ҜеҢ–й“қжә¶ж¶Іи’ёе№ІпјҢзҒјзғ§пјҢжңҖеҗҺеҫ—еҲ°зҡ„еӣәдҪ“дә§зү©жҳҜ__________гҖӮ пјҲ3пјүе®һйӘҢе®Өй…ҚеҲ¶FeSO4жә¶ж¶ІпјҢжә¶и§Јж—¶е…ҲиҰҒеҠ е…Ҙе°‘йҮҸзҡ„зЁҖзЎ«й…ёпјҢе…¶еҺҹеӣ жҳҜ___________________(з”ЁзҰ»еӯҗж–№зЁӢејҸе’ҢйҖӮеҪ“ж–Үеӯ—иҜҙжҳҺ)пјӣй…ҚеҲ¶е®ҢжҜ•еҗҺиҰҒеҠ е…Ҙе°‘йҮҸй“Ғеұ‘пјҢе…¶зӣ®зҡ„жҳҜ____________________________гҖӮ пјҲ4пјүtв„ғж—¶пјҢжҹҗNaOHзЁҖжә¶ж¶Ідёӯc(H+)=10пјҚa molВ·LпјҚ1пјҢc(OHпјҚ)=10пјҚb molВ·LпјҚ1пјҢе·ІзҹҘa+b=12пјҢеҲҷпјҡ в‘ иҜҘжё©еәҰдёӢж°ҙзҡ„зҰ»еӯҗз§Ҝеёёж•°Kw=________________пјӣ в‘ЎеңЁиҜҘжё©еәҰдёӢпјҢе°Ҷ100mL 0.1 molВ·LпјҚ1зҡ„зЁҖH2SO4дёҺ100mL 0.4 molВ·LпјҚ1зҡ„NaOHжә¶ж¶Іж··еҗҲеҗҺпјҢжә¶ж¶Ізҡ„pH= _____________гҖӮ гҖҗзӯ”жЎҲгҖ‘ NaHSO4=Na++H++SO42- й…ё Al2O3 Fe2++2H2OвҮҢFe(OH)2+2H+ жҠ‘еҲ¶Fe2+ж°ҙи§Ј йҳІжӯўFe2+ж°§еҢ– 1.0Г—10-12 11 гҖҗи§ЈжһҗгҖ‘пјҲ1пјү. NaHSO4жҳҜејәй…ёзҡ„й…ёејҸзӣҗпјҢеңЁж°ҙжә¶ж¶Ідёӯе®Ңе…Ёз”өзҰ»пјҢз”өзҰ»ж–№зЁӢејҸдёәпјҡNaHSO4=Na++H++SO42-пјҢж•…зӯ”жЎҲдёәпјҡNaHSO4=Na++H++SO42-пјӣ пјҲ2пјү.AlCl3жҳҜејәй…ёејұзўұзӣҗпјҢж°ҙи§ЈдҪҝжә¶ж¶Іе‘Ҳй…ёжҖ§пјӣAl3пјӢпјӢ3H2O пјҲ3пјү.е®һйӘҢе®Өй…ҚеҲ¶FeSO4жә¶ж¶ІпјҢеӣ дәҡй“ҒзҰ»еӯҗеҸ‘з”ҹж°ҙи§ЈпјҡFe2++2H2O пјҲ4пјү.в‘ . tв„ғж—¶пјҢжҹҗNaOHзЁҖжә¶ж¶Ідёӯc(H+)=10пјҚa molВ·LпјҚ1пјҢc(OHпјҚ)=10пјҚb molВ·LпјҚ1пјҢеҲҷKw= c(H+)Г—c(OHпјҚ)= 10пјҚa molВ·LпјҚ1Г—10пјҚb molВ·LпјҚ1=1.0Г—10пјҚ(a+b)пјҢе·ІзҹҘa+b=12пјҢеҲҷKw=1.0Г—10пјҚ12пјҢж•…зӯ”жЎҲдёәпјҡ1.0Г—10пјҚ12пјӣ в‘ЎеңЁиҜҘжё©еәҰдёӢпјҢ100mL 0.1 molВ·LпјҚ1зҡ„зЁҖH2SO4жә¶ж¶ІдёӯnпјҲH+пјү=0.1LГ—0.1 molВ·LпјҚ1Г—2=0.02molпјҢ100mL 0.4 molВ·LпјҚ1зҡ„NaOHжә¶ж¶ІдёӯnпјҲOHпјҚпјү=0.1LГ—0.4 molВ·LпјҚ1=0.04molпјҢдёӨжә¶ж¶Іж··еҗҲеҗҺж°ўж°§ж №зҰ»еӯҗиҝҮйҮҸпјҢжүҖеҫ—жә¶ж¶ІдёӯcпјҲOHпјҚпјү= 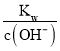 =10пјҚ11mol/LпјҢеҲҷpH= пјҚlgcпјҲH+пјү=11пјҢж•…зӯ”жЎҲдёәпјҡ11гҖӮ =10пјҚ11mol/LпјҢеҲҷpH= пјҚlgcпјҲH+пјү=11пјҢж•…зӯ”жЎҲдёәпјҡ11гҖӮгҖҗйўҳеһӢгҖ‘з»јеҗҲйўҳ гҖҗз»“жқҹгҖ‘ 24 гҖҗйўҳзӣ®гҖ‘е·ІзҹҘ25 в„ғж—¶,йғЁеҲҶејұз”өи§ЈиҙЁзҡ„з”өзҰ»е№іиЎЎеёёж•°ж•°жҚ®еҰӮдёӢиЎЁпјҡ
|
|||||||||
| 23. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҸҜйҖҶеҸҚеә”A(g)пјӢB(g) в‘ з”ұT1еҗ‘T2еҸҳеҢ–ж—¶пјҢжӯЈеҸҚеә”йҖҹзҺҮ______йҖҶеҸҚеә”йҖҹзҺҮ(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ в‘Ўз”ұT3еҗ‘T4еҸҳеҢ–ж—¶пјҢжӯЈеҸҚеә”йҖҹзҺҮ______йҖҶеҸҚеә”йҖҹзҺҮ(еЎ«вҖң>вҖқвҖң<вҖқжҲ–вҖң=вҖқ)гҖӮ в‘ўеҸҚеә”еңЁ________жё©еәҰдёӢиҫҫеҲ°е№іиЎЎгҖӮ |
|
- 2018-2019е№ҙй«ҳдәҢдёҠеҶҢ第дәҢж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲж–°з–Ҷз»ҙеҗҫе°”иҮӘжІ»еҢәзҹіжІіеӯҗдәҢдёӯпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲжІіеҢ—зңҒзҹіе®¶еә„еёӮи—ҒеҹҺеҢә第дёҖдёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдёҖдёӢеҶҢ2жңҲд»Ҫж‘ёеә•иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·пјҲжөҷжұҹзңҒиҗ§еұұдёӯеӯҰпјү
- еӨ©жҙҘеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢиҜҫж—¶з»ғд№ жЁЎжӢҹиҖғиҜ•з»ғд№
- 2018-2019е№ҙй«ҳдәҢеүҚеҚҠжңҹжңҹжң«з»ҹиҖғеҢ–еӯҰиҖғйўҳпјҲеұұиҘҝзңҒеҗ•жўҒеёӮпјү
- жұүдёӯеёӮе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- 2018иҮі2019е№ҙй«ҳдәҢдёӢжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰиҖғйўҳеҗҢжӯҘи®ӯз»ғпјҲе№ҝиҘҝеЈ®ж—ҸиҮӘжІ»еҢәжҹіе·һй«ҳдёӯпјү
- жұҹиҘҝзңҒеҚ—жҳҢеёӮиҝӣиҙӨеҺҝ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдёҖдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ



