高一下半期期末考试化学考题同步训练免费试卷(2019-2020年广东省广州市越秀区省实越秀学校)
| 1. 选择题 | 详细信息 |
|
化学与人类生产、生活密切相关,下列有关说法不正确的是 A.利用铝热反应焊接铁轨 B.“光化学烟雾”的形成与氮氧化合物有关 C.用活性炭为糖浆脱色和用SO2漂白纸浆的原理相同 D.用烧碱处理含高浓度NH4+的废水并回收利用氨 |
|
| 2. 选择题 | 详细信息 |
|
化学在人类生活中扮演着重要角色,下列说法正确的是 A.聚乙烯塑料不会对环境造成污染 B.与煤、柴油相比较,天然气是一种比较清洁的化石燃料 C.通过蒸发可从海水中提取溴、碘、镁 D.煤经过气化和液化等物理变化可以转化为清洁燃料 |
|
| 3. 选择题 | 详细信息 |
|
下列说法正确的是 A. 红磷、白磷属于同分异构体 B. H2、D2属于同素异形体 C. |
|
| 4. 选择题 | 详细信息 |
|
下列微粒的化学用语正确的是 A.质子数为53,中子数为78的碘原子: C. 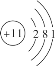 D.NH3的电子式 D.NH3的电子式 |
|
| 5. 选择题 | 详细信息 |
如图所示,电流表A指针发生偏转,同时M极质量减少,N极有气泡冒出,B为电解质溶液。则M、N、B分别为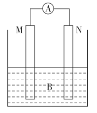 A.M是Cu,N是Zn,B是稀硫酸 B.M是Zn,N是Cu,B是CuCl2溶液 C.M是Fe,N是Al,B是NaOH溶液 D.M是Fe,N是Ag,B是稀硫酸 |
|
| 6. 选择题 | 详细信息 |
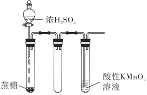
用如右图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是( )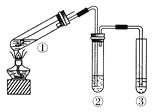 A. 上下移动①中铜丝可控制SO2的量 B. ②中选用品红溶液验证SO2的生成 C. ③中选用NaOH溶液吸收多余的SO2 D. 为确认CuSO4生成,向①中加水,观察颜色 |
|
| 7. 选择题 | 详细信息 |
|
下列叙述中,不正确的是 A.原子最外层电子数为2的元素一定处于周期表第ⅡA族 B.第VⅡA族元素都是非金属元素 C.室温时,0族元素的单质都是气体 D.碱金属元素在自然界中都以化合态存在 |
|
| 8. 选择题 | 详细信息 |
如图是部分短周期元素主要化合价与原子序数关系图,下列说法不正确的是 A.X的非金属性强于W B.原子半径;Y>Z>X C.R和Y构成的化合物可用来冶炼金属钠 D.将WX2通入BaCl2溶液中产生白色沉淀 |
|
| 9. 选择题 | 详细信息 |
如图是产生和收集气体的实验装置示意图,该装置适合于( ) A.用浓硝酸和Cu制取NO2 B.用H2O2溶液和MnO2制取O2 C.用浓盐酸和MnO2制取Cl2 D.用NH4Cl溶液和Ca(OH)2制取NH3 |
|
| 10. 选择题 | 详细信息 |
|
工业制硫酸中的一步重要反应是SO2在400-500℃下的催化氧化: A.在上述条件下,SO2不可能100%地转化为SO3 B.使用催化剂是为了加快反应速率,提高生产效率 C.达到平衡时,SO2与O2的浓度比始终保持2:1 D.为了提高SO2的转化率,可以适当提高O2的浓度 |
|
| 11. 选择题 | 详细信息 |
某有机物的结构简式如图所示,下列说法不正确的是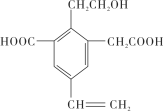 A.该有机物可以与溴水发生加成反应 B.该有机物可以与乙酸发生酯化反应 C.该有机物既能与Na反应,还能与NaOH、Na2CO3反应 D.1mol该有机物最多可以和6molH2发生加成反应 |
|
| 12. 选择题 | 详细信息 |
|
下列说法正确的是 A.可用碘水检验淀粉是否水解完全 B.油脂都不能使溴水褪色 C.葡萄糖、果糖和蔗糖都能发生水解反应 D.糖类、油脂、蛋白质都是由C、H、O三种元素组成的 |
|
| 13. 选择题 | 详细信息 |
某小组为研究原电池原理,设计如图装置。下列叙述不正确的是 A.a和b不连接时,铁片上会有金属铜析出 B.a和b用导线连接时,铜片上发生的反应为: C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 D.a和b用导线连接时,电子由铜片通过导线流向铁片,溶液中的Cu2+得电子 |
|
| 14. 选择题 | 详细信息 |
下列反应中热量变化与图像不一致的是 A.CO与O2反应 B.NaOH溶液和HNO3溶液反应 C.镁条和盐酸反应 D.NH4Cl晶体和Ba(OH)2·8H2O晶体反应 |
|
| 15. 选择题 | 详细信息 |
海洋中有丰富的资源,下图为海水资源利用的部分过程。下列有关说法正确的是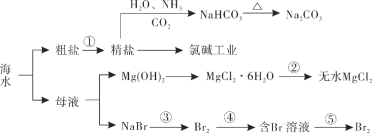 A.①为除去“粗盐”中的MgCl2、CaCl2、Na2SO4,依次加入过量的NaOH、Na2CO3、BaCl2溶液即可 B.工业上常采用将②得到的产物溶于水后通电的方法制取金属镁 C.通过第③④⑤步可以达到富集溴的目的 D.用澄清石灰水可鉴别NaHCO3溶液和Na2CO3溶液 |
|
| 16. 选择题 | 详细信息 |
|
下列说法中正确的是 A.共价化合物中只有共价键,离子化合物中只有离子键 B.CCl4、CO2分子中每个原子最外层均满足8电子结构 C.将某种化合物溶于水,若能导电说明这种化合物是离子化合物 D.C2H6中碳链为直线型,含有极性键和非极性键,可推测C3H8也是碳链为直线型,也含有极性键和非极性键。 |
|
| 17. 选择题 | 详细信息 |
|
检验溶液中是否含有某种离子,取样后,下列操作方法正确的是 A.加入稀盐酸,无明显现象,再加入BaCl2溶液产生白色沉淀,证明有 B.加入浓盐酸产生能使品红溶液褪色的气体,证明有 C.加入稀盐酸,放出能使澄清的石灰水变浑浊的气体,证明有 D.加入浓氢氧化钠溶液后加热,产生使湿润蓝色石蕊试纸变红的气体,证明有 |
|
| 18. 选择题 | 详细信息 |
普通锌锰干电池的简图如图,该电池工作时的总反应为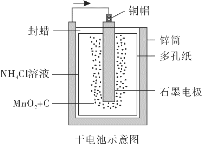 A.当该电池电压逐渐下降后,能重新充电复原 B.电池工作一段时间后,碳棒会逐渐变细 C.电池工作时,电流由负极通过外电路流向正极 D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
|
| 19. 选择题 | 详细信息 | |||||||||||||||
下列实验方案中,实验装置正确且能达到相应实验目的的是
|
||||||||||||||||
| 20. 选择题 | 详细信息 |
一定温度下,向容积为4L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,下列对反应的推断合理的是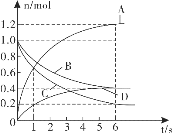 A.该反应的化学方程式为 B.反应进行到1s时, C.反应进行到6s时,B的平均反应速率为 D.反应进行到6s时,各物质的反应速率相等 |
|
| 21. | 详细信息 |
下表是元素周期表的一部分,针对表中的①~⑩十种元素,填写下列空白: (1)形成化合物种类最多的元素的原子结构示意图为_____________,该元素有多种核素,其中一种考古时用于测定文物年代,请写出其原子符号____________。 (2)③⑤⑦三种元素的单质中,熔点最高的是____________(写化学式),元素⑨的气态氢化物的电子式为____________,将⑩的单质通入该氢化物的水溶液中,发生反应的离子方程式为____________。 (3)这十种元素中,非金属性最强的元素为____________(写元素符号);⑧⑨⑩三种元素的最高价氧化物对应的水化物中,酸性最弱的是____________(写化学式)。 (4)⑤⑨⑩三种元素的简单离子半径,由大到小依次为____________(写离子符号)。 (5)1889年,门捷列夫获得用元素⑥的单质制成的奖杯,以表彰其编制化学元素周期表的贡献。这种单质当时无比珍贵,如今已广泛使用。现在工业上冶炼该单质的化学方程式____________。 |
|
| 22. | 详细信息 |
|
过氧化氢分解一直是科学研究的热点。 Ⅰ.研究温度对 (1)H2O2分解时,温度会明显上升,表明反应物总能量____________于生成物总能量。(填“高”或“低”) (2)按图1组装仪器,在试管中加入过氧化氢和蒸馏水,在恒温水浴中浸泡2min后,加入CuSO4溶液。实验记录和数据处理见表1。 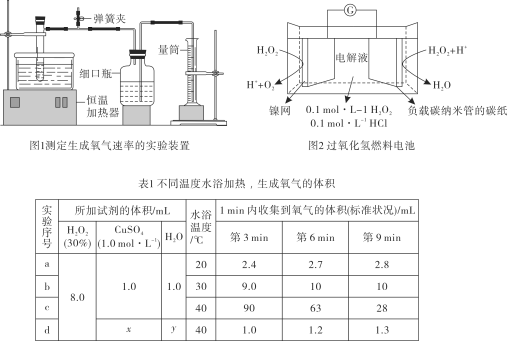 ①必须使用恒温水浴的原因是____________。 ②实验c的第9min,生成O2物质的量为____________mmol(1mmol=10-3mol),H2O2的平均反应速率为v(H2O2)=____________ ③由实验a、b、c可知,升温加快O2生成。为确认升温时加快了H2O2自身分解还是加强了Cu2+的催化效果,需进一步开展实验d,其中x=____________,y=____________,结果表明后者成立。 Ⅱ.研究过氧化氢燃料电池 (3)一种过氧化氢燃料电池装置如图2。 ①“负载碳纳米管的碳纸”作____________极(填“正”或“负”),发生____________反应(填“氧化”或“还原”),补全其电极反应式:H2O2+2H++____________=2H2O。 ②电子的流向为____________(填选项序号)。 a.镍网→外电路→碳纸 b.碳纸→外电路→镍网 c.碳纸→溶液→镍网 d.镍网→溶液→碳纸 ③碳纳米管是理想的电极材料,以下说法不属于其优点的是____________(填选项序号) A.化学性质活泼 B.导电性强 C.耐腐蚀 D.催化性能好 E.表面积大 (4)与利用化学反应放出的热量相比,利用燃料电池供能的显著优势是____________。 |
|
最近更新