2018年至2019年高一下半期期末考试化学免费试卷完整版(吉林省吉林市三校)
| 1. 选择题 | 详细信息 |
|
A. 质子数为6 B. 电子数为13 C. 中子数为6 D. 质量数为6 |
|
| 2. 选择题 | 详细信息 |
|
可以用分液漏斗进行分离的混合物是 A. 酒精和碘水 B. 苯和水 C. 乙酸和乙酸乙酯 D. 乙酸和水 |
|
| 3. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数,下列说法不正确的是: A. 23gNa做还原剂可提供电子数为NA B. 在标准状况下,1mol戊烷的所含的原子数为17NA C. 常温常压下,22.4LNH3所含电子数目为10NA D. 常温常压下,1mol氩气含有原子数为NA |
|
| 4. 选择题 | 详细信息 |
|
下列叙述正确的是: A. 元素的单质可由氧化或还原含该元素的化合物来制得 B. 得电子越多的氧化剂,其氧化性就越强 C. 阳离子只能得到电子被还原,只能作氧化剂 D. 含有高价元素的化合物,一定具有强的氧化性 |
|
| 5. 选择题 | 详细信息 |
|
当干冰熔化或气化时,下列各项中发生变化的是: A. 化学键 B. 分子间作用力 C. 分子构型 D. 分子大小 |
|
| 6. 选择题 | 详细信息 |
|
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应为:2H2+O2==2H2O,电解液为KOH,反应保持在较高温度,使H2O蒸发。下列叙述正确的是: A. 此电池能发出蓝色火焰 B. H2为正极,O2为负极 C. 工作时,电解液的pH不断减小 D. 此电池反应只生成水,对环境没有污染 |
|
| 7. 选择题 | 详细信息 |
|
下列排列顺序正确的是: A. 微粒半径:Na+>K+>Cl->S2- B. 稳定性:HI> HBr>HCl>HF C. 酸性: H2SO4> HClO4>H3PO4>H2SiO4 D. 熔点: Al > Mg > Na > K |
|
| 8. 选择题 | 详细信息 |
|
有关药品的保存和使用正确的是: A. 溴水存放在橡胶塞的细口试剂瓶中 B. 新制的氯水存放在棕色瓶中 C. 盛放烧碱的试剂瓶应用玻璃塞 D. 金属钠保存在乙醇中 |
|
| 9. 选择题 | 详细信息 |
|
下列各组物质,互为同分异构体的是: A. 金刚石和足球烯(C60) B. 尿素[(NH2)2CO] 和氰酸铵(NH4CNO) C. H2O和D2O D. 苯和甲苯 |
|
| 10. 选择题 | 详细信息 |
|
在元素周期表中金属元素与非金属元素的分界线附近的一些元素能用于制( ) A. 合金 B. 半导体 C. 催化剂 D. 农药 |
|
| 11. 选择题 | 详细信息 |
|
下列说法不正确的是 A. 在共价化合物中一定含有共价键 B. 含有离子键的化合物一定是离子化合物 C. 含有共价键的化合物一定是共价化合物 D. 化学反应过程中,反应物分子内的化学键断裂,产物分子的化学键形成 |
|
| 12. 选择题 | 详细信息 |
|
海带中含有碘元素,某校研究性学习小组设计了如下实验步骤来提取碘: ①通足量氯气②将海带烧成灰,向灰中加水搅拌③加CC14振荡④过滤⑤用分液漏斗分液。合理的操作顺序为 ( ) A. ①→③→⑤→②→④ B. ②→①→③→④→⑤ C. ②→④→①→③→⑤ D. ③→①→②→⑤→④ |
|
| 13. 选择题 | 详细信息 |
|
把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b为负极;c、d相连时,电流由d到c。则这四种金属的活动性顺序由大到小为: A. a>c>b>d B. a>b>c>d C. c>a>b>d D. b>d>c>a |
|
| 14. 选择题 | 详细信息 |
|
两种气态烃组成的混和气体0.1mol完全燃烧得0.16摩尔CO2和3.6gH2O,下列说法正确的( ) A. 一定有乙烯 B. 一定是甲烷和乙烯 C. 一定有乙炔 D. 一定有甲烷 |
|
| 15. 选择题 | 详细信息 |
|
甲基丙烯酸甲酯是世界上年产量超过100万吨的高分子单体,旧法合成的反应是 (CH3)2C==O+HCN→ (CH3)2C(OH)CN (CH3)2C(OH)CN+CH3OH+H2SO4→CH2== C(CH3)COOCH3+NH4HSO4, 90年代新的反应是:CH3C≡CH+CO+CH3OH A. ①② B. ③④ C. ①③ D. ②④ |
|
| 16. 选择题 | 详细信息 |
|
用30g乙酸与46g乙醇反应,如果实际产率是理论产率的67%,则可得到的乙酸乙酯的质量是 A. 29.5g B. 44g C. 74.8g D. 88g |
|
| 17. 选择题 | 详细信息 |
|
已知X、Y、Z为三种原子序数相连的元素,最高价氧化物对应水化物的酸性相对强弱是:HXO4>H2YO4>H3ZO4。则下列说法正确的是 A. 气态氢化物的稳定性:HX>H2Y>ZH3 B. 非金属性:Y<X<Z C. 原子半径:X>Y>Z D. 原子序数:Z>Y>X |
|
| 18. 选择题 | 详细信息 |
|
某一化学反应在0.5L的密闭容器中,反应物B的物质的量在5s内从2.0mol变成0.5mol,在这5s内B的化学反应速率为: A. 3mol/L B. 0.3mol/L•s C. 0.6mol/L•s D. 0.1mol/L•s |
|
| 19. 填空题 | 详细信息 |
|
根据元素周期表1~20号元素的性质和递变规律,回答下列问题。 (1)属于金属元素的有____种,金属性最强的元素与氧气反应生成的化合物有____(填两种化合物的化学式)。 (2)属于稀有气体的是____(填元素符号,下同)。 (3)形成化合物种类最多的两种元素是____。 (4)第三周期中,原子半径最大的是(稀有气体除外)____。 (5)推测Si、N最简单氢化物的稳定性____大于____(填化学式)。 |
|
| 20. 填空题 | 详细信息 |
|
请将所选下列物质的转化或分离方法的序号填在横线上(每一项只填写一种方法)。 ①溶解 ②裂解 ③分馏 ④裂化 ⑤干馏 ⑥蒸馏 ⑦电解 ⑧过滤 ⑨萃取 (1)把煤转化为焦炉气、煤焦油和焦炭等___________。 (2)从原油中分离出汽油、煤油、柴油等______________。 (3)将重油转化为汽油____________。 (4)将海水淡化_________________。 (5)从海水得到的无水MgC12中提取金属镁_____________。 |
|
| 21. 填空题 | 详细信息 |
已知:A是自石油的重要有机化工原料,E是具有果香味的有机物,F是一种高聚物,可制成多种包装材料。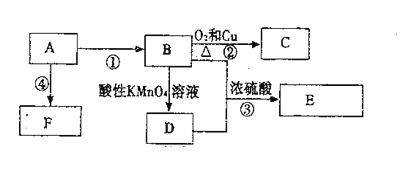 (1)A的电子式为________________,C的名称________________,F的结构简式________________。 (2)D分子中的官能团名称是________________,请设计一种实验来验证D物质存在该官能团的方法是____________________________。 (3)写出下列反应的化学方程式并指出反应类型:③________________,反应类型________________。 |
|
| 22. 填空题 | 详细信息 |
|
(1)微粒 (2)用电子式表示下列化合物的形成过程 H2S____________; MgF2____________。 |
|
| 23. 填空题 | 详细信息 |
|
某同学取三份锌粒,放入三只烧杯中,然后在甲、乙两只烧杯中分别加入2mol/L的盐酸、稀硫酸各45mL,丙烧杯中加入刚刚用5mL18mol/L的浓硫酸稀释而成的45mL稀硫酸溶液,若反应终止时,生成的气体一样多,且锌粒没有剩余。 (1)参加反应的锌的质量:甲___________乙_________丙(填“>”、“<”、“=”,下同)。 (2)反应速率,甲__________乙,原因是___________。 (3)反应完毕 所需时间:乙____________丙,原因是__________。 |
|
| 24. 计算题 | 详细信息 |
|
有锌--铜和稀硫酸组成的原电池,当导线中有0.2摩尔电子转移时,问: (1)负极金属质量减少多少克?___________ (2)正极产生的(标准状况下)气体的体积?_________ |
|
最近更新



