河池市高一化学上册期末考试刷题训练
| 1. 选择题 | 详细信息 |
|
在化学反应:3Fe+4H2O(g) A.还原剂 B.氧化剂 C.既不是还原剂也不是氧化剂 D.溶剂 |
|
| 2. 选择题 | 详细信息 |
|
下列各组物质,前者逐滴滴加到后者中至过量,先出现白色沉淀,后来沉淀又全部消失的是( ) A.硫酸滴加到偏铝酸钠溶液中 B.氢氧化钡溶液滴加到硫酸铝溶液中 C.氨水滴加到硫酸铝溶液中 D.硫酸铝溶液滴加到氢氧化钠溶液中 |
|
| 3. 选择题 | 详细信息 |
|
利用阿伏加德罗定律及其推论,判断下列说法正确的说法是( ) A. 同温同压下两种气体的体积之比等于摩尔质量之比 B. 同温同压下两种气体的物质的量之比等于密度之比 C. 同温同压下两种质量相同的气体其体积比之比等于摩尔质量之比 D. 同温同体积下两种气体的物质的量之比等于压强之比 |
|
| 4. 选择题 | 详细信息 |
|
NA代表阿伏加德罗常数,下列说法中错误的是( ) A. 1mol氢气含有的原子数为2NA B. NA个水分子中含有氢原子的物质的量为2 mol C. 1 mol 氧气中含有的分子数为2NA D. 含有NA个氧原子的硫酸的物质的量是0.25 mol |
|
| 5. 选择题 | 详细信息 |
|
盛有氯化钡稀溶液的甲、乙两试管分别通入SO2至饱和,若向甲试管中加入足量双氧水,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是( ) A.甲、乙两试管都有白色沉淀生成 B.甲、乙两试管都没有白色沉淀生成 C.甲试管没有白色沉淀生成而乙试管有 D.甲试管有白色沉淀生成而乙试管没有 |
|
| 6. 选择题 | 详细信息 |
|
芯片是电脑、“智能”加点的核心部件,它是用高纯度硅制成的。下面是生产单质硅过程中的一个重要反应:SiO2 + 2C=Si +2CO↑,该反应的基本类型是 A.化合反应 B.分解反应 C.置换反应 D.复分解反应 |
|
| 7. 选择题 | 详细信息 |
|
春秋季节在我市常出现大雾天气,对于这种现象下列说法正确的是 A.大雾是由于空气中的SO2超标造成的 B.大雾可看作是一种分散剂为水的分散系 C.大雾可看作是一种胶体 D.大雾是由于空气中的粉尘超标造成的 |
|
| 8. 选择题 | 详细信息 |
|
已知2NaOH+Br2===NaBr+NaBrO+H2O,若从溴水中把溴萃取出来,可选用的萃取剂是( ) A. 食盐饱和溶液 B. 无水酒精 C. 四氯化碳 D. 氢氧化钠溶液 |
|
| 9. 选择题 | 详细信息 |
|
实验室加热高锰酸钾制取氧气,用排水法收集满氧气后,下一步应采取的操作及原因是 A. 先熄灭酒精灯,以节约燃烧 B. 先把导管移出水面,再熄灭酒精灯以免水倒吸引起试管炸裂 C. 先撤酒精灯,再撤导气管,防止水倒吸 D. 检验收集的气体是否纯净 |
|
| 10. 选择题 | 详细信息 |
|
下列说法中,正确的是( ) A.标准状况下,22.4 L水中含有6.02×1023个水分子 B.32 g氧气所含的原子数目为2×6.02×1023 C.常温常压下,0.5×6.02×1023个一氧化碳分子所占的体积是11.2 L D.1 mol CaCl2溶于水配成1 L溶液,所得溶液中Cl﹣的物质的量浓度为1 mol·L-1 |
|
| 11. 选择题 | 详细信息 |
|
明矾可以净水是因为( ) A. 明矾在水中能电离出硫酸根离子 B. 明矾含有钾离子和铝离子两种阳离子 C. 明矾溶于水后能生成氢氧化铝胶体 D. 明矾能与碱反应生成氢氧化铝沉淀 |
|
| 12. 选择题 | 详细信息 |
|
向一定量铁、氧化铁、氧化亚铁的混合物中加入1000mL0.1 mol·L-1的盐酸,恰好完全溶解,所得溶液中加硫氰化钾溶液无红色出现。若用足量一氧化碳还原相同质量的此混合物,能得到铁的质量是( ) A. 11.2g B. 2.8g C. 5.6g D. 无法计算 |
|
| 13. 选择题 | 详细信息 |
|
飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的作用可能是 A.氧化剂 B.还原剂 C.催化剂 D.载体 |
|
| 14. 选择题 | 详细信息 |
|
某溶液中含有Na+、SO42-、CO32-、HCO3-4种离子,若向其中加入少量过氧化钠固体后,溶液中离子浓度基本保持不变的是 A. HCO3- B. Na+ C. CO32- D. SO42- |
|
| 15. 选择题 | 详细信息 |
|
下列属于合金的是( ) A.黄铜 B.黄金 C.石墨 D.氧化铁 |
|
| 16. 选择题 | 详细信息 |
|
下列反应属于氧化还原反应,且水中两种元素化合价没有改变的是 A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2↑ C. CaO+H2O=Ca(OH) 2 D. 3NO2+H2O=2HNO3+NO |
|
| 17. 选择题 | 详细信息 |
|
下列配制的溶液浓度偏高的是( ) A. 配制盐酸用量筒量取盐酸时俯视刻度线 B. 配制盐酸定容时,仰视容量瓶刻度线 C. 称量4.0gNaOH配制0.1 mol·L-1NaOH溶液1000mL时,砝码错放在左盘 D. NaOH溶解后未经冷却立即注入容量瓶至刻度线 |
|
| 18. 选择题 | 详细信息 |
如图表示的是纯净物、单质、化合物、含氧化合物、氧化物、碱之间的关系,若整个大圆圈代表纯净物,则下列选项中,能正确指出①、②、③、④、⑤所属物质类别的是( ) A.①单质、③化合物 B.②碱、⑤氧化物 C.④碱、⑤含氧化合物 D.④含氧化合物、③氧化物 |
|
| 19. 选择题 | 详细信息 |
|
用以下三种途径来制取相同质量的硝酸铜:①铜与浓硝酸反应;②铜与稀硝酸反应;③铜与氧气反应生成氧化铜,氧化铜再与硝酸反应。下列叙述正确的是( ) A.三种途径所消耗的铜的物质的量不相等 B.三种途径所消耗的硝酸的物质的量相等 C.所消耗铜的物质的量是:途径③>途径①>途径② D.所消耗硝酸的物质的量是:途径①>途径②>途径③ |
|
| 20. 选择题 | 详细信息 |
|
下列有关分散系的叙述中不正确的是( ) A.胶体分散质微粒直径较大,不能透过滤纸 B.液态分散系根据分散质粒子大小分为溶液、胶体和浊液三类 C.利用丁达尔效应可以区分溶液和胶体 D.纳米材料分散到液体分散剂中得到的分散系属于胶体 |
|
| 21. 选择题 | 详细信息 |
|
下列除去杂质(括号内的物质为杂质)的方法中错误的是 A. FeSO4(CuSO4):加足量铁粉后,过滤 B. CO (CO2):用NaOH溶液洗气后干燥 C. CO2(HCl):用NaOH溶液洗气后干燥 D. MnO2(KCl):加水溶解后,过滤、洗涤、烘干 |
|
| 22. 选择题 | 详细信息 |
|
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( ) A.若M甲>M乙,则气体体积:甲<乙 B.若M甲<M乙,则气体的压强:甲>乙 C.若M甲>M乙,则气体的摩尔体积:甲<乙 D.若M甲<M乙,则气体的分子数:甲<乙 |
|
| 23. 选择题 | 详细信息 |
|
在标准状况下,质量为m的气体A与质量为n的气体B的分子数相同,下列说法中不正确的是( ) A.气体A与气体B的相对分子质量比为m:n B.同质量气体A与气体B的分子个数比为n:m C.同温同压下,A气体与B气体的密度比为n:m D.相同状况下,同体积的A气体与B气体的质量比为m:n |
|
| 24. 选择题 | 详细信息 |
|
在蒸发结晶实验中,可能用到的仪器是( ) A.坩埚 B.烧杯 C.蒸发皿 D.石棉网 |
|
| 25. 实验题 | 详细信息 |
根据下图所示装置回答以下问题。已知:①KMnO4常温下与浓盐酸反应可制得Cl2。②H2SiO3不溶于水。 (1)利用如图装置可以验证元素非金属性的变化规律。图中A装置的名称是________________。干燥管D的作用是____________。 (2)实验室中现有药品Na2S、KMnO4、浓盐酸、MnO2,请选择合适药品设计实验验证氯的非金属性强于硫:烧瓶中发生反应的离子方程式为____________________________。装置C中的实验现象为有淡黄色沉淀生成,离子方程式为_____________________。 (3)若要用此装置证明酸性:HNO3>H2CO3>H2SiO3,进而证明非金属性:N>C>Si,从以下所给物质中选出甲同学设计的实验所用到的物质:①稀HNO3 ②稀盐酸 ③碳酸钙 ④Na2SiO3溶液 ⑤SiO2。试剂A与C分别为________(填序号);试管中发生反应的离子方程式为__________________。有同学认为此实验不能说明N、C、Si的非金属性强弱,你认为原因是_____________________。 |
|
| 26. 推断题 | 详细信息 |
某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如下图所示(部分反应物和生成物未列出),其中E为白色胶状沉淀,I为红褐色沉淀。(此转化关系中所用的试剂都是足量的)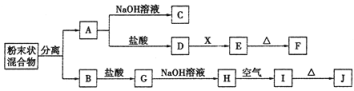 (1)写出下列物质的化学式:F____________,G________________。 (2)将混合物中两种金属分离开的最简单的方法是___________。 (3)D→E的转化中,加入过量的X可能是_____________________。 A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液 (4)写出下列转化的化学方程式: A→C:______________________________________________; H→I:_______________________________________________。 |
|
| 27. 实验题 | 详细信息 |
某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。 (1)A中发生反应的化学反应方程式为________________________________ (2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题: ①在装置D中能看到的实验现象分别是 ___________________ ; ②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________; ③装置F中球形干燥管的作用是____________________________; (3)储气瓶b内盛放的试剂是______________________________; (4)B处发生反应的离子方程式为___________________________________。 |
|
| 28. 综合题 | 详细信息 |
A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断: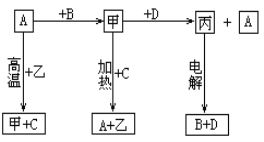 (1)甲的化学式为_____________,丙的化学式为______________。 (2)写出甲和D反应的化学方程式___________________________________________。 (3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。 A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液 (4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验: 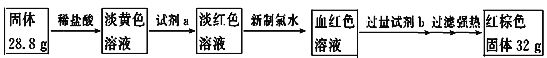 化合物甲的质量分数为________________。 |
|
| 29. 推断题 | 详细信息 |
A、B、C、D、E分别是铁或铁的化合物。其中D是一种红褐色沉淀。其相互反应关系如图所示: 根据如图所示变化,按要求回答下列问题: (1)写出A、E的化学式:A__,E__; (2)写出其中几步反应的化学方程式: C→B:___; B→D:___; E→A:___。 (3)C中加入NaOH溶液,看到的现象是__。 |
|
| 30. 推断题 | 详细信息 |
|
下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。 (1)把与下面元素有关性质相符的曲线标号填入相应的空格中: a.  b. b.  c. c.  d. d.  ①第ⅡA族元素的价电子数________。 ②第三周期元素的最高化合价________。 ③F-、Na+、Mg2+、Al3+的离子半径________。 (2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答: ①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。 ②N的最高价氧化物的水化物的化学式为________________。 ③M的最高价氧化物的化学式为________________________。 |
|
最近更新



