四川省绵阳南山中学 2020届三诊模拟考试理综化学免费试卷完整版
| 1. 选择题 | 详细信息 |
|
化学是现代生产、生活与科技的中心学科之一,下列与化学有关的说法,正确的是 A.2022年冬奥会聚氨酯速滑服,是新型无机非金属材料 B.石墨烯是由单层碳原子构成的平面结构新型碳材料,属于烯烃 C.顾名思义,苏打水就是苏打的水溶液,也叫弱碱性水,是带有弱碱性的饮料 D.人们洗发时使用的护发素,其主要功能是调节头发的pH使之达到适宜的酸碱度 |
|
| 2. 选择题 | 详细信息 |
萝卜硫素(结构如图)是具有抗癌和美容效果的天然产物之一,在一些十字花科植物中含量较丰富。该物质由五种短周期元素构成,其中W、X、Y、Z的原子序数依次增大,Y、Z原子核外最外层电子数相等。下列叙述一定正确的是( )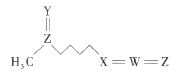 A.原子半径的大小顺序为Z>W>X>Y B.X的简单氢化物与W的氢化物反应生成离子化合物 C.萝卜硫素中的各元素原子最外层均满足8电子稳定结构 D.Y、Z形成的二元化合物的水化物为强酸 |
|
| 3. 选择题 | 详细信息 |
依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。其中装置正确且能达到相应实验目的是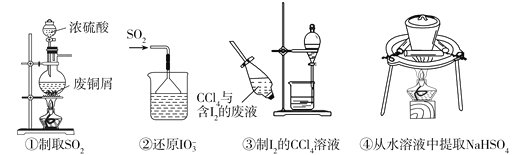 A. ①②③④ B. ①②③ C. ②③④ D. ②④ |
|
| 4. 选择题 | 详细信息 |
|
下列关于有机物 a( A.a、b 互为同系物 B.C 中所有碳原子可能处于同一平面 C.b 的同分异构体中含有羧基的结构还有 7 种(不含立体异构) D.a 易溶于水,b 、c 均能使酸性高猛酸钾溶液褪色 |
|
| 5. 选择题 | 详细信息 |
国际能源期刊报道了一种正在开发中的绿色环保“全氢电池”,有望减少废旧电池产生污染。其工作原理如图所示。下列说法正确的是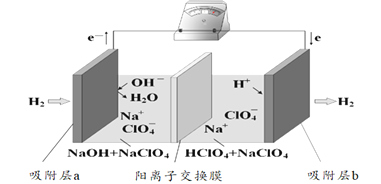 A.“全氢电池”工作时,将酸碱反应的中和能转化为电能 B.吸附层b发生的电极反应:H2 – 2e- + 2 OH-= 2H2O C.Na+ 在装置中从右侧透过阳离子交换膜向左侧移动 D.“全氢电池”的总反应: 2H2 + O2 =2H2O |
|
| 6. 选择题 | 详细信息 |
实验室利用SO2和Cl2在活性炭作用下制取SO2C12,原理为SO2(g)+Cl2(g)⇌SO2Cl2(l) ∆H=-97.3kJ/mol。装置如图所示(部分装置已省略)。已知SO2C12的熔点为-54.1℃,沸点为69.1℃,遇水能发生剧烈反应并产生白雾。下列说法正确的是 A.乙中盛放的试剂为无水氯化钙 B.制备过程中需要将装置甲置于冰水浴中 C.用来冷却的水应该从a口入,b口出 D.可用硝酸与亚硫酸钠反应制备二氧化硫 |
|
| 7. 选择题 | 详细信息 |
某温度下,向10mL 0.1mol·L-1 CuCl2溶液中滴加0.1mol·L-1的Na2S溶液,滴加过程中-lg c(Cu2+)与Na2S溶液体积的关系如图所示。已知:Ksp(ZnS)=3×10-25,下列有关说法正确的是 A.Na2S溶液中:c(H+)+c(HS-)+c(H2S)=c(OH-) B.a、b、c三点对应的溶液中,水的电离程度最小的为b点 C.c点溶液中c(Cu2+)=10-34.4 mol·L-1 D.向100mL Zn2+、Cu2+物质的量浓度均为0.1mol·L-1的混合溶液中逐滴加入10-3 mol·L-1的Na2S溶液,Zn2+先沉淀 |
|
| 8. 综合题 | 详细信息 |
|
氮及其化合物对环境具有显著影响。 (1)已知汽车气缸中氮及其化合物发生如下反应: ①N2(g)+O2(g) ⇌2NO(g) △H=+180 kJ/mol ②N2(g)+2O2(g) ⇌ 2NO2(g) △H=+68 kJ/mol 则2NO(g)+O2(g) ⇌2NO2(g) △H=_____kJ/mol (2)对于反应2NO(g)+O2(g) ⇌ 2NO2(g)的反应历程如下: 第一步:2NO(g) 第二步:N2O2(g)+O2(g) 其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ正=k1 正·c2(NO),υ 逆=k1 逆·c(N2O2),k1正、k1 逆为速率常数,仅受温度影响。下列叙述正确的是_____ a.整个反应的速率由第一步反应速率决定 b.同一温度下,平衡时第一步反应的 c.第二步反应速率慢,因而平衡转化率也低 d.第二步反应的活化能比第一步反应的活化能高 (3)将氨气与二氧化碳在有催化剂的反应器中反应 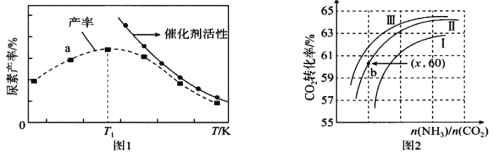 ①a点_____(填是或不是)处于平衡状态,T1之后尿素产率下降的原因可能是 _____________。 ②实际生产中,原料气带有水蒸气,图2表示CO2的转化率与氨碳比 (4)N2H4可作火箭推进剂。已知25℃时N2H4水溶液呈弱碱性:N2H4+H2O⇌N2H5++OH- K1= ①25℃时,向N2H4水溶液中加入H2SO4,欲使c(N2H5+ )>c(N2H4 ),同时c(N2H5+)>c(N2H62+),应控制溶液pH范围__________(用含a、b式子表示)。 ②水合肼(N2H4·H2O)的性质类似一水合氨,与硫酸反应可以生成酸式盐,该盐的化学式为__________。 |
|
| 9. | 详细信息 |
二氧化氯(ClO2)广泛应用于纸浆漂白、杀菌消毒和水净化处理等领域。工业上利用甲醇还原NaClO3的方法制备ClO2,工艺流程如下: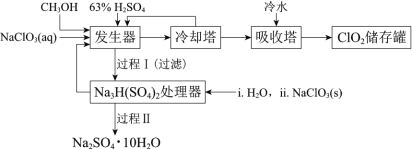 已知:a.发生器中制备ClO2的反应:12NaClO3+8H2SO4+3CH3OH=12ClO2↑+3HCOOH+4Na3H(SO4)2↓+9H2Ob.相关物质的熔沸点:  (1)ClO2可用于纸浆漂白、杀菌消毒是因其具有_____性。 (2)冷却塔用于分离ClO2并回收CH3OH,应控制的最佳温度为 ______________(填字母)。 a.0~10℃ b.20~30℃ c.60~70℃ (3)可以获得芒硝(Na2SO4·10H2O)并使部分原料循环利用。已知:Na2SO4·10H2O和Na2SO4的溶解度曲线如图: 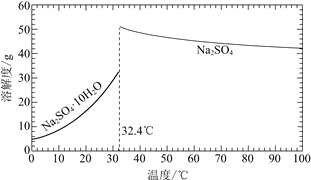 ① Na3H(SO4)2处理器中获得芒硝时需加入NaClO3固体,从芒硝溶解平衡的角度解释其原因 __(结合方程回答)。 ②结合Na2SO4·10H2O和Na2SO4的溶解度曲线,过程Ⅱ的操作是:在32.4℃恒温蒸发,_______。 ③Na3H(SO4)2处理器的滤液中可以循环利用的原料是NaClO3和_____。 (4)为测定存储罐中所得溶液中ClO2的含量,进行了以下实验: 步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。 步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇 匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平) 步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32-=2I-+S4O62-) ①准确量取10.00 mL ClO2溶液的玻璃仪器是______。 ②若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果_____ (填“偏高”、“偏低”或“无影响”) ③根据上述步骤可计算出原ClO2溶液的浓度为_____mol·L-1(用含字母的代数式表示)。 (5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。ClO2的有效氯含量为_______。(计算结果保留两位小数) |
|
| 10. 实验题 | 详细信息 |
|
苯胺 已知:① ②用硝基苯制取苯胺的反应原理: 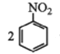 +3Sn+12HCl +3Sn+12HCl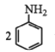 +3SnCl4+4H2O +3SnCl4+4H2O③有关物质的部分物理性质见下表: 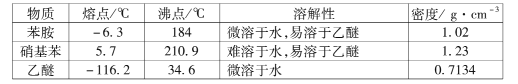 I.比较苯胺与氨气的性质 (1)将分别蘸有浓氨水和浓盐酸的玻璃棒靠近,产生白烟,反应的化学方程式为____;用苯胺代替浓氨水重复上述实验,却观察不到白烟,原因是____。 Ⅱ.制备苯胺 往图1所示装置(夹持装置略,下同)的冷凝管口分批加入20mL浓盐酸(过量),置于热水浴中回流20min,使硝基苯充分还原;冷却后,往三颈烧瓶中滴入一定量50% NaOH溶液,至溶液呈碱性。 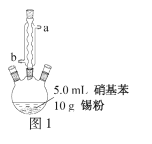 (2)冷凝管的进水口是____(填“a”或“b”); (3)滴加NaOH溶液的主要目的是析出苯胺,反应的离子方程式为____。 Ⅲ.提取苯胺 i.取出图1所示装置中的三颈烧瓶,改装为图2所示装置。加热装置A产生水蒸气,烧瓶C中收集到苯胺与水的混合物;分离混合物得到粗苯胺和水溶液。  ii.往所得水溶液中加入氯化钠固体,使溶液达到饱和状态,再用乙醚萃取,得到乙醚萃取液。 iii.合并粗苯胺和乙醚萃取液,用NaOH固体干燥,蒸馏后得到苯胺2.79g。 (4)装置B无需用到温度计,理由是____。 (5)操作i中,为了分离混合物,取出烧瓶C前,应先打开止水夹d,再停止加热,理由是____。 (6)该实验中苯胺的产率为____。 (7)欲在不加热条件下除去苯胺中的少量硝基苯杂质,简述实验方案:____。 |
|
| 11. 综合题 | 详细信息 |
|
2018年11月《物理评论快报》报道了艾姆斯实验室制造的包含钙、钾、铁和砷以及少量镍的CaK(Fe1-xNix)4As4新型化合物材料,呈现出被称为刺猬自旋新磁态。有助于更好理解磁性 与非常规超导性之间的联系。回答下列问题: (1)基态镍原子的价电子排布式为_______;上述材料中所含元素的基态原子中,未成对电子数最多的是_______ (填元素符号)。 (2)铁及其离子易形成配离子,如[Fe(CN)6]3-、[Fe(CN)x]4-、Fe(CO)5等。所包括的非金属元素中第一电离能最大的是______(填元素符号);[Fe(CN)6] 4-中含有σ键与π键的数目比为_____________。 (3)K3AsO3可用于碘的微量分析。 ①AsO33-的立体构型为_______,写出一种与其互为等电子体的分子_______(填化学式)。 ②K+的焰色反应呈紫色,金属元素能产生焰色实验的微观原因为_______。 (4)Ni与Ca处于同一周期,且核外最外层电子构型相同,但金属Ni的熔点和沸点均比金属Ca的高,其原因为_______。 (5)①金属镍的原子堆积方式如图所示,则金属镍晶胞俯视图为_______。  a.  b. b. c. c. d. d. ②某砷镍合金的晶胞如图所示,设阿伏加德罗常数的值为NA,该晶体的密度ρ=_____g·cm-3。  |
|
| 12. 推断题 | 详细信息 |
花椒毒素(Ⅰ)是白芷等中草药的药效成分,也可用多酚A为原料制备,合成路线如下: 回答下列问题: (1)①的反应类型为_____________________;B分子中最多有_________个原子共平面。 (2)C中含氧官能团的名称为______________________;③的“条件a”为____________________。 (3)④为加成反应,化学方程式为__________________________________。 (4)⑤的化学方程式为__________________________________。 (5)芳香化合物J是D的同分异构体,符合下列条件的J的结构共有_________种,其中核磁共振氢谱为五组峰的J的结构简式为_________________。(只写一种即可)。 ①苯环上只有3个取代基;②可与NaHCO3反应放出CO2;③1mol J可中和3mol NaOH。 (6)参照题图信息,写出以 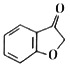 为原料制备 为原料制备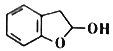 的合成路线(无机试剂任选) :______________ 的合成路线(无机试剂任选) :______________ |
|
最近更新



