жұҹиӢҸзңҒжө·е®үеёӮ2020-2021е№ҙй«ҳдёҖеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
| 1. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
жҚ®еҫ·еӣҪгҖҠеә”з”ЁеҢ–еӯҰгҖӢжҠҘйҒ“вҲ¶дёӯ科йҷўеӨ§иҝһеҢ–еӯҰзү©зҗҶз ”з©¶жүҖеңЁдәҢж°§еҢ–зўіз”өеӮ¬еҢ–иҝҳеҺҹж–№йқўеҸ–еҫ—ж–°иҝӣеұ•пјҢе®һзҺ°дәҢж°§еҢ–зўіеҲ°дёҖж°§еҢ–зўіеҶҚеҲ°з”Ізғ·зҡ„иҪ¬еҢ–гҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A.CO2иғҪеј•иө·жё©е®Өж•Ҳеә” B.CH4еҲҶеӯҗжҳҜжӯЈеӣӣйқўдҪ“еҪўеҲҶеӯҗ C.CO еұһдәҺй…ёжҖ§ж°§еҢ–зү© D.иҜҘиҪ¬еҢ–е®һзҺ°дәҶ CO2зҡ„иө„жәҗеҢ–еҲ©з”Ё |
|
| 2. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
NaClжҳҜеҺЁжҲҝдёӯеёёи§Ғзҡ„и°ғе‘іеүӮгҖӮй…ҚеҲ¶1molВ·L-1жә¶ж¶Іж—¶пјҢеӣәдҪ“жә¶и§ЈиҝҮзЁӢеҰӮеӣҫжүҖзӨәгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ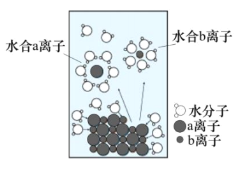 A.aзҰ»еӯҗдёәCl- B.NaCl зҒјзғ§ж—¶зҒ«з„°е‘ҲзҺ°жө…зҙ«иүІ C.жә¶ж¶Ідёӯеҗ«жңү6.02Г—1023дёӘNa+ D.NaCl жә¶дәҺж°ҙж—¶еҸӘиғҪйғЁеҲҶз”өзҰ» |
|
| 3. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж°Ҝж°”жҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеҰӮпјҡе·ҘдёҡдёҠз”ЁжқҘеҲ¶зӣҗй…ёгҖҒжјӮзҷҪзІүзӯүгҖӮе·ҘдёҡдёҠеҲ©з”Ёжө“ж°Ёж°ҙеҗёж”¶ж°Ҝж°”е·Ҙдёҡзҡ„е°ҫж°”пјҢеҸҚеә”з”ҹжҲҗNH4ClпјҢиҜҘжҠҖжңҜй«ҳж•Ҳзҡ„еӨ„зҗҶе°ҫж°”дёӯзҡ„ж°Ҝж°”еҗҢж—¶еҫ—еҲ°еүҜдә§е“ҒNH4ClгҖӮеҸҚеә”зҡ„ж–№зЁӢејҸдёәпјҡ A.HClжҳҜе…ұд»·еҢ–еҗҲзү© B.жө“ж°Ёж°ҙжҳҜз”өи§ЈиҙЁ C.NH4Cl еұһдәҺзӣҗ D.жјӮзҷҪзІүжҳҜж··еҗҲзү© |
|
| 4. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж°Ҝж°”жҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеҰӮпјҡе·ҘдёҡдёҠз”ЁжқҘеҲ¶зӣҗй…ёгҖҒжјӮзҷҪзІүзӯүгҖӮе·ҘдёҡдёҠеҲ©з”Ёжө“ж°Ёж°ҙеҗёж”¶ж°Ҝж°”е·Ҙдёҡзҡ„е°ҫж°”пјҢеҸҚеә”з”ҹжҲҗNH4ClпјҢиҜҘжҠҖжңҜй«ҳж•Ҳзҡ„еӨ„зҗҶе°ҫж°”дёӯзҡ„ж°Ҝж°”еҗҢж—¶еҫ—еҲ°еүҜдә§е“ҒNH4ClгҖӮеҸҚеә”зҡ„ж–№зЁӢејҸдёәпјҡ A.дёӯеӯҗж•°дёә20зҡ„й’ҷеҺҹеӯҗвҲ¶ C.NH4Clзҡ„з”өеӯҗејҸвҲ¶  D.Cl-зҡ„з»“жһ„зӨәж„ҸеӣҫвҲ¶ D.Cl-зҡ„з»“жһ„зӨәж„ҸеӣҫвҲ¶  |
|
| 5. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
ж°Ҝж°”жҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеҰӮпјҡе·ҘдёҡдёҠз”ЁжқҘеҲ¶зӣҗй…ёгҖҒжјӮзҷҪзІүзӯүгҖӮе·ҘдёҡдёҠеҲ©з”Ёжө“ж°Ёж°ҙеҗёж”¶ж°Ҝж°”е·Ҙдёҡзҡ„е°ҫж°”пјҢеҸҚеә”з”ҹжҲҗNH4ClпјҢиҜҘжҠҖжңҜй«ҳж•Ҳзҡ„еӨ„зҗҶе°ҫж°”дёӯзҡ„ж°Ҝж°”еҗҢж—¶еҫ—еҲ°еүҜдә§е“ҒNH4ClгҖӮеҸҚеә”зҡ„ж–№зЁӢејҸдёәпјҡ A.Cl2е…·жңүж°§еҢ–жҖ§пјҢдёҺNH3еҸҚеә”ж—¶еҫ—еҲ°з”өеӯҗ B.NH3е…·жңүиҝҳеҺҹжҖ§пјҢеңЁеҸҚеә”дёӯж°®е…ғзҙ е…ЁйғЁиў«ж°§еҢ– C.иӢҘжңү22.4LN2з”ҹжҲҗпјҢеҲҷиҮіе°‘йңҖ3molCl2еҸӮдёҺеҸҚеә” D.иҜҘеҸҚеә”дёӯеҸӘеҸ‘з”ҹе…ұд»·й”®зҡ„ж–ӯиЈӮдёҺеҪўжҲҗ |
|
| 6. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дҫҜж°ҸеҲ¶зўұжі•зҡ„еҺҹзҗҶдёәвҲ¶ A.OH- B.H+ C. |
|
| 7. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—жҢҮе®ҡеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ A.з”ЁзҹізҒ°зҹідёҺзӣҗй…ёеҸҚеә”еҲ¶CO2пјҡ B.H2SO4дёҺBa(OH)2еҸҚеә”вҲ¶ C.ж°Ҝж°”жә¶дәҺж°ҙвҲ¶ D.й“қдёҺNaOHжә¶ж¶ІеҸҚеә”вҲ¶ |
|
| 8. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еңЁз»ҷе®ҡжқЎд»¶дёӢпјҢдёӢеҲ—йҖүйЎ№жүҖзӨәзҡ„зү©иҙЁй—ҙиҪ¬еҢ–еқҮиғҪе®һзҺ°зҡ„жҳҜ A. B. C. D. |
|
| 9. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
з»ҸзҒјзғ§гҖҒжә¶и§ЈгҖҒиҝҮж»ӨгҖҒжЈҖйӘҢеӣӣдёӘжӯҘйӘӨеҸҜзЎ®е®ҡй»‘жңЁиҖідёӯжҳҜеҗҰеҗ«жңүй“Ғе…ғзҙ пјҢдёӢеҲ—еӣҫзӨәиЈ…зҪ®жҲ–еҺҹзҗҶдёҚиғҪиҫҫеҲ°е®һйӘҢзӣ®зҡ„жҳҜ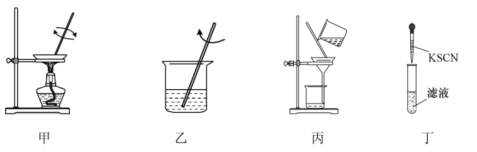 A.еӣҫз”Іе°Ҷй»‘жңЁиҖізҒјзғ§жҲҗзҒ° B.еӣҫд№ҷз”Ёжө“зӣҗй…ёжә¶и§ЈзҒ°зғ¬е№¶еҠ ж°ҙзЁҖйҮҠ C.еӣҫдёҷиҝҮж»Өеҫ—еҲ°ж»Өж¶І D.еӣҫдёҒжЈҖйӘҢж»Өж¶ІдёӯжҳҜеҗҰеҗ«жңүFe3+ |
|
| 10. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁзҡ„жҖ§иҙЁдёҺз”ЁйҖ”е…·жңүеҜ№еә”е…ізі»зҡ„жҳҜ A.NaHCO3е…·жңүдёҚзЁіе®ҡжҖ§пјҢеҸҜз”ЁдәҺжІ»з–—иғғй…ёиҝҮеӨҡ B.Cl2е…·жңүејәж°§еҢ–жҖ§пјҢеҸҜз”ЁдҪңзәёеј зҡ„жјӮзҷҪеүӮ C.FeCl3жә¶ж¶Іжҳҫй…ёжҖ§пјҢеҸҜз”ЁдҪңиҡҖеҲ»й“ңз”өи·Ҝжқҝ D.й“ҒзІүе…·жңүиҝҳеҺҹжҖ§пјҢеҸҜз”ЁдҪңйЈҹе“Ғзҡ„жҠ—ж°§еҢ–еүӮ |
|
| 11. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWзҡ„еҺҹеӯҗеәҸж•°дҫқж¬ЎеўһеӨ§гҖӮXжҳҜз©әж°”дёӯеҗ«йҮҸжңҖеӨҡзҡ„е…ғзҙ гҖӮYдёҺZзҡ„еҺҹеӯҗеәҸж•°д№Ӣе’Ңдёә 24пјҢдё”еҗҢдё»ж—ҸгҖӮдёӢеҲ—еҸҷиҝ°дёҚжӯЈзЎ®зҡ„жҳҜ A.W дҪҚдәҺе…ғзҙ е‘ЁжңҹиЎЁдёӯ第 3 е‘Ёжңҹ VII ж—Ҹ B.Y йҳҙзҰ»еӯҗзҡ„еҚҠеҫ„жҜ” ZйҳҙзҰ»еӯҗеҚҠеҫ„е°Ҹ C.Y з®ҖеҚ•ж°”жҖҒж°ўеҢ–зү©зҡ„зғӯзЁіе®ҡжҖ§жҜ” X зҡ„ејә D.Wзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”ж°ҙеҢ–зү©зҡ„й…ёжҖ§жҜ”Zзҡ„ејә |
|
| 12. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
еҢ–еҗҲд»·е’Ңзү©иҙЁзұ»еҲ«жҳҜж•ҙзҗҶе…ғзҙ еҸҠеҢ–еҗҲзү©зҹҘиҜҶзҡ„дёӨдёӘиҰҒзҙ пјҢеҸҜиЎЁзӨәдёәвҖңд»·зұ»вҖқдәҢз»ҙеӣҫгҖӮдёӢеӣҫжҳҜй“Ғе…ғзҙ зҡ„вҖңд»·зұ»вҖқдәҢз»ҙеӣҫпјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ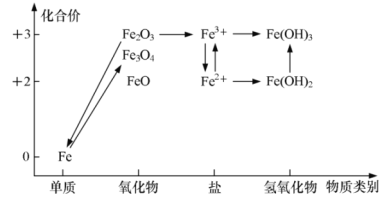 A.еёёжё©дёӢ FeдёҺж°ҙеҸҚеә”з”ҹжҲҗ Fe3O4 B.е·ҘдёҡдёҠз”Ё CO иҝҳеҺҹ Fe2O3зӮјй“ҒпјҢиҜҘеҸҚеә”еұһдәҺзҪ®жҚўеҸҚеә” C.з»ҙз”ҹзҙ CиғҪе°Ҷ Fe3+иҪ¬еҢ–дёә Fe2+пјҢиҝҮзЁӢдёӯз»ҙз”ҹзҙ CеҒҡиҝҳеҺҹеүӮ D.Fe(OH)2жөҠж¶ІйңІзҪ®дәҺз©әж°”дёӯпјҢзҷҪиүІиҝ…йҖҹиҪ¬еҸҳдёәзәўиӨҗиүІ |
|
| 13. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
жҹҗеӯҰз”ҹдёәжҺўз©¶ж–°еҲ¶ж°Ҝж°ҙзҡ„жҖ§иҙЁпјҢиҝӣиЎҢдёӢеҲ—е®һйӘҢпјҢж №жҚ®е®һйӘҢж“ҚдҪңе’ҢзҺ°иұЎеҫ—еҮәзҡ„з»“и®әдёҚжӯЈзЎ®зҡ„жҳҜ
|
||||||||||||||||
| 14. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
йҡҸеҺҹеӯҗеәҸж•°зҡ„йҖ’еўһпјҢе…«з§Қзҹӯе‘Ёжңҹе…ғзҙ (з”Ёеӯ—жҜҚxзӯүиЎЁзӨә)зҡ„еҺҹеӯҗеҚҠеҫ„гҖҒжңҖй«ҳжӯЈд»·жҲ–жңҖдҪҺиҙҹд»·зҡ„еҸҳеҢ–еҰӮдёӢеӣҫжүҖзӨәгҖӮ дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ A.eгҖҒfгҖҒg жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёӨдёӨд№Ӣй—ҙиғҪзӣёдә’еҸҚеә” B.xгҖҒzгҖҒdз»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡжҳҜе…ұд»·еҢ–еҗҲзү© C.yгҖҒdгҖҒe з»„жҲҗзҡ„еҢ–еҗҲзү©ж°ҙжә¶ж¶ІдёҖе®ҡе‘ҲдёӯжҖ§ D.dдёҺeз»„жҲҗзҡ„еҢ–еҗҲзү©дёҖе®ҡеҸӘеҗ«зҰ»еӯҗй”® |
|
| 15. йҖүжӢ©йўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
зЈ·й…ёдәҡй“Ғй”Ӯ(LiFePO4)жҳҜж–°еһӢй”Ӯз”өжұ зҡ„жӯЈжһҒжқҗж–ҷпјҢLiFePO4еҸҜйҖҡиҝҮLi2CO3+H2C2O4+2FePO4=2LiFePO4+H2O+3CO2 A.иҜҘеҲ¶еӨҮеҺҹзҗҶдёӯH2C2O4дҪңж°§еҢ–еүӮ B.з”ұ LiFePO4еҸҳжҲҗ Li1-xFePO4ж—¶пјҢеұһдәҺиҝҳеҺҹеҸҚеә” C.еёёжё©еёёеҺӢдёӢз”ҹжҲҗ6.6 g CO2ж—¶пјҢеҸҚеә”дёӯиҪ¬з§»0.1 mol з”өеӯҗ D.еҪ“Li1-xFePO4дёӯx=0.4ж—¶пјҢLi1-xFePO4дёӯзҡ„Fe2+е’ҢFe3+дёӘж•°д№ӢжҜ”дёә2вҲ¶3 |
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
жҺ§еҲ¶е’ҢжІ»зҗҶдәҢж°§еҢ–зЎ«пјҢжҳҜи§ЈеҶій…ёйӣЁй—®йўҳзҡ„жңүж•ҲйҖ”еҫ„гҖӮ (1)SO2жҳҜй…ёжҖ§ж°§еҢ–зү©пјҢеҸҜз”ЁNaOHжә¶ж¶Іеҗёж”¶еҗ« SO2зҡ„е°ҫж°”пјҢиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸдёә___________гҖӮ (2)з”ЁNaClOзўұжҖ§жә¶ж¶Іеҗёж”¶дәҢж°§еҢ–зЎ«гҖӮе·ҘдёҡдёҠжҺ§еҲ¶еңЁ40в„ғ~50в„ғж—¶пјҢе°Ҷеҗ«жңүSO2зҡ„зғҹж°”е’ҢNaClO зўұжҖ§жә¶ж¶ІжҢүеӣҫзӨәж–№ејҸйҖҡе…ҘеҸҚеә”йҮңпјҢеҸ‘з”ҹеҸҚеә”вҲ¶NaClO+SO2+2NaOH=NaCl+Na2SO4+H2OгҖӮ  в‘ иҜҘеҸҚеә”дёӯпјҢSO2иЎЁзҺ°еҮә___________еЎ«еҶҷе…·дҪ“еҢ–еӯҰжҖ§иҙЁ)гҖӮ в‘Ў еҸҚеә”йҮңдёӯйҮҮз”ЁвҖңж°”вҖ”ж¶ІйҖҶжөҒвҖқжҺҘи§Ұеҗёж”¶жі•зҡ„дјҳзӮ№жҳҜ___________гҖӮ в‘ў дёәдәҶжҸҗй«ҳSO2зҡ„еҗёж”¶ж•ҲзҺҮпјҢе·ҘдёҡдёҠеёёеҠ Ni2O3дҪңеӮ¬еҢ–еүӮпјҢеӮ¬еҢ–иҝҮзЁӢеҰӮеӣҫ1жүҖзӨәгҖӮеңЁеӮ¬еҢ–иҝҮзЁӢдёӯпјҢеҸҚеә”дә§з”ҹзҡ„еӣӣд»·й•Қе’Ңж°§еҺҹеӯҗе…·жңүејәж°§еҢ–иғҪеҠӣпјҢиғҪеҠ еҝ«еҗёж”¶йҖҹеәҰгҖӮиҜ•еҶҷеҮәиҝҮзЁӢ2зҡ„зҰ»еӯҗж–№зЁӢејҸвҲ¶___________гҖӮ (3)зўҳгҖҒж°ҙеҗёж”¶дәҢж°§еҢ–зЎ«пјҢе…·дҪ“жөҒзЁӢеҰӮеӣҫ2 жүҖзӨәгҖӮ  е·ІзҹҘвҲ¶ I2жҳ“еҚҮеҚҺпјӣзЎ«й…ёжҳҜй«ҳжІёзӮ№еҗ«ж°§й…ёпјҢHIжҳ“жҢҘеҸ‘гҖӮ в‘ еңЁеҸҚеә”еҷЁдёӯпјҢжҺ§еҲ¶жё©еәҰдёҚи¶…иҝҮ100в„ғзҡ„зӣ®зҡ„жҳҜ___________гҖӮ в‘Ў еңЁеҲҶзҰ»еҷЁдёӯпјҢеҲҶзҰ»H2SO4е’ҢHIзҡ„ж–№жі•дёә___________(еЎ«еӯ—жҜҚ)гҖӮ aпјҺиҝҮж»Ө bпјҺи’ёйҰҸ cпјҺ з»“жҷ¶ в‘ў зўҳгҖҒж°ҙеҗёж”¶дәҢж°§еҢ–зЎ«зҡ„жҖ»еҸҚеә”ж–№зЁӢејҸдёә___________гҖӮ в‘Ј иҜҘе·ҘиүәдёӯеҸҜд»ҘеҫӘзҺҜдҪҝз”Ёзҡ„зү©иҙЁжҳҜ___________гҖӮ |
|
| 17. е®һйӘҢйўҳ | иҜҰз»ҶдҝЎжҒҜ |
|
еҗ«ж°Ҝж¶ҲжҜ’еүӮгҖҒеҢ»з”Ёй…’зІҫгҖҒиҝҮж°§еҢ–зү©зӯүеқҮиғҪжңүж•ҲзҒӯжҙ»з—…жҜ’пјҢдёәжҠ—еҮ»ж–°еһӢеҶ зҠ¶иӮәзӮҺ (COVID-19)дҪңеҮәдәҶиҙЎзҢ®гҖӮиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳвҲ¶ (1)дёӢеҲ—зү©иҙЁз”ЁдҪңж¶ҲжҜ’еүӮж—¶пјҢеҺҹзҗҶдёҺе…¶е®ғдёҚеҗҢзҡ„жҳҜ___________(еЎ«еӯ—жҜҚ)гҖӮ AпјҺ NaClO BпјҺ ClO2 CпјҺ еҢ»з”Ёй…’зІҫ DпјҺ H2O2 (2)е…ҙи¶Је°Ҹз»„ж¬ІжҺўз©¶иҝҮж°§еҢ–й’ ж ·е“ҒжҳҜеҗҰеҸҳиҙЁпјҢиҝӣиЎҢдёӢеҲ—ж“ҚдҪңвҲ¶еҸ–е°‘йҮҸж ·е“ҒпјҢжә¶и§ЈпјҢеҠ е…Ҙ_________пјҢжҢҜиҚЎпјҢжңүзҷҪиүІжІүж·Җдә§з”ҹпјҢиҜҒжҳҺ Na2O2е·ІеҸҳиҙЁгҖӮ (3)дәҡж°Ҝй…ёй’ (NaClO2)жҳҜдёҖз§Қй«ҳж•Ҳж°§еҢ–еүӮгҖҒжјӮзҷҪеүӮпјҢеҸҜз”ұClO2дёҺCl2OжҢүдёҖе®ҡжҜ”дҫӢж··еҗҲеҗҺеңЁNaOHжә¶ж¶ІдёӯеҸҚеә”еҲ¶еҫ—гҖӮ в‘ NaClO2дёӯж°Ҝе…ғзҙ зҡ„еҢ–еҗҲд»·жҳҜ___________гҖӮ в‘Ў еҲ¶еӨҮж—¶ Cl2O дёҺ ClO2е®Ңе…ЁеҸҚеә”зҡ„зү©иҙЁзҡ„йҮҸзҗҶи®әжҜ”дёә___________гҖӮ в‘ў еңЁдёҖе®ҡжқЎд»¶дёӢпјҢе°ҶCl2йҖҡе…ҘеЎ«е……жңүеӣәдҪ“NaClO2зҡ„еҸҚеә”жҹұеҶ…е°Ҷе…¶ж°§еҢ–дёәClO2.еҪ“ж¶ҲиҖ—ж ҮеҮҶзҠ¶еҶөдёӢ 1.12 L Cl2ж—¶пјҢеҸҜеҲ¶еҫ— ClO2___________gгҖӮ (4)е…ҙи¶Је°Ҹз»„и®ҫи®ЎеҰӮдёӢеӣҫе®һйӘҢиЈ…зҪ®еҲ¶еҸ–е°‘йҮҸжјӮзҷҪж¶ІгҖӮ 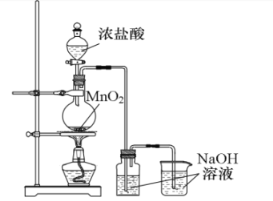 в‘ MnO2дёҺжө“ HCl еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә___________гҖӮ в‘Ў е……еҲҶеҸҚеә”еҗҺпјҢжөӢеҫ—жјӮзҷҪж¶ІдёӯNaClOиҙЁйҮҸеҲҶж•°еҒҸдҪҺгҖӮз»ҸеҲҶжһҗеҸҜиғҪзҡ„еҺҹеӣ жңүвҲ¶ IпјҺ___________(з”Ёж–Үеӯ—з®Җиҝ°)гҖӮ в…ЎпјҺж°Ҝж°”дёҺNaOHеҸҚеә”ж”ҫзғӯпјҢжё©еәҰиҫғй«ҳж—¶з”ҹжҲҗNaClO3пјҢиҜҘеҸҚеә”ж–№зЁӢејҸдёә___________гҖӮ |
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
жҹҗе…ҙи¶Је°Ҹз»„з”ЁйғЁеҲҶж°§еҢ–зҡ„FeSO4дёәеҺҹж–ҷпјҢеҲ¶еҸ–й«ҳзәҜеәҰзҡ„Fe2O3пјҢ并жөӢе®ҡдә§е“Ғдёӯй“Ғе…ғзҙ еҗ«йҮҸпјҢдё»иҰҒж“ҚдҪңжӯҘйӘӨеҰӮдёӢвҲ¶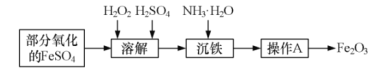 (1)еҶҷеҮәеҠ е…ҘH2O2еҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸвҲ¶ ___________гҖӮ (2)з®Җиҝ°жЈҖйӘҢжә¶и§ЈиҝҮзЁӢдёӯFe2+жҳҜеҗҰе·Іиў«е®Ңе…Ёж°§еҢ–жҲҗFe3+зҡ„е®һйӘҢж“ҚдҪңвҲ¶ ___________(еҸҜйҖүжӢ©зҡ„иҜ•еүӮвҲ¶ й…ёжҖ§KMnO4жә¶ж¶ІгҖҒKSCN жә¶ж¶ІгҖҒж°Ҝж°ҙ)гҖӮ (3)ж“ҚдҪңAеҢ…жӢ¬___________гҖҒжҙ—ж¶ӨгҖҒ___________пјӣ з®Җиҝ°жЈҖйӘҢFe(OH)3жҳҜеҗҰжҙ—еҮҖзҡ„ж“ҚдҪңвҲ¶___________гҖӮ (4)еҮҶзЎ®з§°еҸ–4.00gFe2O3дә§е“ҒпјҢз»Ҹй…ёжә¶гҖҒиҝҳеҺҹдёәFe2+пјҢеҮҶзЎ®й…ҚжҲҗ100mLжә¶ж¶ІгҖӮеҸ–25.00mLдәҺй”ҘеҪўз“¶дёӯпјҢеҠ е…Ҙ20.50mL 0.10 molВ·L-1 K2Cr2O7жә¶ж¶ІжҒ°еҘҪе®Ңе…ЁеҸҚеә”гҖӮ(еҒҮи®ҫK2Cr2O7дёҚдёҺжқӮиҙЁеҸҚеә”пјҢдёҺFe2+еҸҚеә”дёәвҲ¶ в‘ й…ҚжҲҗ 100mL жә¶ж¶ІжүҖз”Ёзҡ„дё»иҰҒд»ӘеҷЁжңүвҲ¶зҺ»з’ғжЈ’гҖҒзғ§жқҜгҖҒ___________гҖӮ в‘Ўдә§е“Ғдёӯй“Ғе…ғзҙ зҡ„еҗ«йҮҸдёә___________гҖӮ |
|
| 19. еЎ«з©әйўҳ | иҜҰз»ҶдҝЎжҒҜ |
е®Өжё©дёӢеҗ‘10mL 0.1molВ·L-1 Na2CO3дёӯйҖҗж»ҙеҠ е…Ҙ0.1molВ·L-1 HClгҖӮжә¶ж¶Ідёӯеҗ«зўіе…ғзҙ еҫ®зІ’зҡ„зү©иҙЁзҡ„йҮҸйҡҸ pHеҸҳеҢ–зҡ„еӣҫеғҸеҰӮдёӢеӣҫ(CO2еӣ жңүйҖёеҮәжңӘйқўеҮә)гҖӮ (1)еңЁAвҶ’Bзҡ„иҝҮзЁӢдёӯпјҢеҸҚеә”зҡ„зҰ»еӯҗеҸҚеә”ж–№зЁӢејҸдёә___________вҲ¶ BзӮ№жә¶ж¶Ідёӯn(Na+)=___________molгҖӮ (2)й…ҚеҲ¶0.1 molВ·L-1Na2CO3жә¶ж¶Іж—¶пјҢдёӢеҲ—ж“ҚдҪңдјҡеҜјиҮҙжә¶ж¶Іжө“еәҰеҒҸдҪҺзҡ„жҳҜ___________ aпјҺжҙ—ж¶ӨеҗҺе®№йҮҸ瓶жңӘе№ІзҮҘ bпјҺ е°Ҷзғ§жқҜдёӯзҡ„жә¶ж¶ІжІҝзҺ»з’ғжЈ’жіЁе…Ҙе®№йҮҸ瓶еҗҺз«ӢеҚіеҠ ж°ҙе®ҡе®№ cпјҺ е®ҡе®№ж—¶дҝҜи§ҶеҲ»еәҰзәҝ dпјҺ ж‘ҮеҢҖеҗҺеҠ ж°ҙиҮіж¶ІйқўдёҺеҲ»еәҰзәҝзӣёеҲҮ (3)дёәзЎ®е®ҡиҜ•ж ·x Na2CO3В·yNaHCO3зҡ„з»„жҲҗпјҢжҹҗеҗҢеӯҰеҒҡеҰӮдёӢе®һйӘҢвҲ¶ в‘ еҸ–29.6gзҡ„иҜ•ж ·пјҢз”Ёй…’зІҫзҒҜеҜ№е…¶е……еҲҶеҠ зғӯиҮіжҒ’йҮҚпјҢеҶ·еҚҙеҗҺз§°е…¶иҙЁйҮҸдёә26.5gпјҺж®Ӣз•ҷеңЁиҜ•з®Ўдёӯзҡ„еӣәдҪ“жҳҜ___________(еЎ«еҢ–еӯҰејҸ)гҖӮ в‘Ў еҸҰеҸ–иҙЁйҮҸдёә0.296gзҡ„иҜ•ж ·еҠ ж°ҙжә¶и§ЈеҗҺй…ҚжҲҗ50.00mLжә¶ж¶ІпјҢйҖҗж»ҙеҠ е…Ҙ0.2molВ·L-1 HClпјҢиҮіpH=8ж—¶пјҢж¶ҲиҖ—HClжә¶ж¶І10.00mLпјҢ继з»ӯж»ҙеҠ HClиҮіе®Ңе…Ёж—¶пјҢеҸҲж¶ҲиҖ—HClжә¶ж¶І15.00mLпјҢеҲҷиҜ•ж ·дёӯ NaHCO3зҡ„иҙЁйҮҸеҲҶж•°дёә___________гҖӮ |
|
й«ҳдёӯеҢ–еӯҰ иҜ•еҚ·жҺЁиҚҗ
- е®үзҰҸдёӯеӯҰй«ҳдёҖеҢ–еӯҰдёӢеҶҢжңҲиҖғиҜ•еҚ·еҲ·йўҳз»ғд№
- 2018-2019е№ҙй«ҳдәҢеүҚеҚҠжңҹ第дәҢж¬ЎеӨ§иҖғеҢ–еӯҰиҖғиҜ•пјҲе№ҝдёңзңҒж№ӣжұҹеёӮ第дёҖдёӯеӯҰпјү
- 2019-2020е№ҙй«ҳдёҖдёӢеҶҢжңҹжң«иҖғиҜ•еҢ–еӯҰе…Қиҙ№иҜ•йўҳеёҰзӯ”жЎҲе’Ңи§ЈжһҗпјҲиҘҝи—ҸиҮӘжІ»еҢәжӢүиҗЁеёӮйӮЈжӣІз¬¬дәҢй«ҳзә§дёӯеӯҰпјү
- иЎўе·һеӣӣж Ўй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•еңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ
- 2018-2019е№ҙй«ҳдәҢеүҚеҚҠжңҹжңҹжң«иҖғиҜ•еҢ–еӯҰиҖғиҜ•пјҲеҗүжһ—зңҒжқҫеҺҹеёӮжү¶дҪҷеёӮ第дёҖдёӯеӯҰпјү
- ж–°з–Ҷйҳҝе…ӢиӢҸеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҲиҖғиҜ•еҚ·иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- жё©е·һеёӮ2018е№ҙй«ҳдёҖеҢ–еӯҰеүҚеҚҠжңҹжңҹдёӯиҖғиҜ•зҪ‘дёҠеңЁзәҝеҒҡйўҳ
- й«ҳдёүеҢ–еӯҰдёҠеҶҢдё“йўҳз»ғд№ иҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
жңҖиҝ‘жӣҙж–°



