2018山东高三上学期鲁科版高中化学月考试卷
| 1. | 详细信息 |
|
化学与生活密切相关,下列有关说法错误的是 A.以液化石油气代替燃油可减少大气污染 B.用浸泡过高锰酸钾溶液的硅土吸收水果或花朵产生的乙烯,以达到保鲜的目的 C.葡萄糖是人体内主要供能物质,血液中葡萄糖含量过低,会使人患“低血糖”症 D.SO2具有氧化性,可用于漂白纸浆
|
|
| 2. | 详细信息 |
|
下列说法错误的是 A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 B.水玻璃、双氧水、漂粉精、硅胶都是混合物 C.直径在10-9 ~ 10-7mNaCl固体小颗粒分散到水中能形成胶体 D.“陶成雅器”的主要原料是黏土
|
|
| 3. | 详细信息 |
|
下列说法正确的是 A四氯化碳萃取溴水中的溴时,水从分液漏斗下口流出 B.Na2O在空气中久置,最终生成Na2CO3粉末 C.铝、铁、铜在空气中长时间放置,表面均只生成氧化物 D.某溶液中滴加BaCl2溶液,产生不溶于稀硝酸的白色沉淀,该溶液中一定含有Ag+
|
|
| 4. | 详细信息 |
|
下列反应,在一定条件下,反应物至少有一种能完全反应的是 A.过量的氢气与氮气 B.过量的二氧化锰与浓盐酸 C.过量的铜与浓硫酸 D.过量的锌与18 mol/L硫酸
|
|
| 5. | 详细信息 |
|
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应: ①SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ ②Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,下列有关说法错误的是( ) A.氧化性Cr2O72﹣>Fe3+>SO2 B.K2Cr2O7能将Na2SO3氧化成Na2SO4 C.每有1molK2Cr2O7参加反应,转移电子的数目为6NA D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7
|
|
| 6. | 详细信息 |
|
NA为阿伏加德罗常数的值。下列说法正确的是 A.1L0.1mol • L-1 NaHSO4溶液中含有HSO4- 的总数为0.1NA B.CO2 通过 Na2O2 使其增重 bg 时,反应中转移的电子数为 bNA/28 C.标准状况下2.24L的Cl2溶于水,充分反应后转移电子数为0.1NA D.NA个 Fe(OH)3 胶体粒子的质量为107g
|
|
| 7. | 详细信息 |
|
能正确表示下列反应的离子方程式是 A.稀硫酸和Ba(OH)2溶液反应:H++SO42-+Ba2++OH-=BaSO4↓+H2O B.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+ C.室温下,测得氯化铵溶液pH<7,证明一水合氨是弱碱:NH4++2H2O=NH3·H2O+H3O+ D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
|
|
| 8. | 详细信息 |
|
W、X、Y、Z是原子序数依次增大的四种短周期元素,分属于连续的四个主族,电子层数之和为10,四种原子中X原子的半径最大。下列说法正确的是 A.W所在主族的元素的原子次外层电子数不可能为18 B.四种元素有两种元素在第二周期 C.X、Y、Z的最高价氧化物对应的水化物之间能两两反应 D.工业上获得X、Y单质的方法主要是电解其熔融的氯化物
|
|
| 9. | 详细信息 |
|
实验室用标准盐酸溶液测定某NaOH溶液的浓度,用甲基橙作指示剂,下列操作中可能使测定结果偏低的是( ) A.锥形瓶内溶液颜色变化由黄色变橙色,立即记下滴定管液面所在刻度 B.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失 C.酸式滴定管在装酸液前未用标准盐酸溶液润洗2~3次 D.盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
|
|
| 10. | 详细信息 |
|
下列说法正确的是
分别与c(H+)均为0.2 mol • L-1 的盐酸和硫酸反应,后者更剧烈 B.右图实验2中生成红色物质的离子方程式:Al+Cu2+=Al3++Cu C.探究FeCl3和KI溶液反应限度:将1mL0.1mol • L-1 FeCl3溶液加 入到5 mL 0.1mol • L-1KI溶液中,振荡,加苯萃取后,向水层中加 入5滴KSCN溶液,观察现象 D.水电离出的c(H+)=10-10 mol • L-1的溶液:Na+、K+、Cl-、HCO3-可以共存
|
|
| 11. | 详细信息 | ||||||||||||||||||||
|
下列实验操作所对应的的现象、结论均正确的是
|
|||||||||||||||||||||
| 12. | 详细信息 | |||||||||||||||
|
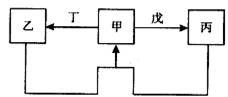
甲、乙、丙、丁、戊五种物质中,甲、乙、丙中均含有某种相同的元素,它们之间具有如下图所示转化关系(反应条件及部分产物已略去)。下列有关物质的推断不正确的是
|
||||||||||||||||
| 13. | 详细信息 |
|
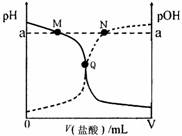
室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。
A.M点所示溶液c(NH4+)+c(NH3·H2O)= c(Cl-) B.N点所示溶液中:c(NH4+)>c(Cl-) C.Q点所示消耗盐酸的体积等于氨水的体积 D.M点和N点所示溶液中水的离子积相同
|
|
| 14. | 详细信息 |
|
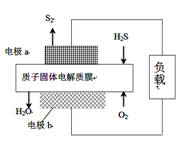
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) A.电路中每流过2mol电子,电池内部释放316kJ热能 B.每34gH2S参与反应,有2mol H+经质子膜进入正极区 C.电极a为电池的负极 D.电极b上发生的电极反应为:O2+4e
|
|
| 15. | 详细信息 | ||||||||||||||||||||||||||||
|
在T℃下,分别在三个容积为10L的恒容绝热密闭容器中,发生反应: 2CO(g)+SO2(g)
下列说法正确的是 A.其他条件不变,容器乙达到平衡后,再充入体系中四种气体各1mol,平衡逆向移动 B.b=1.6 C.平衡常数:K甲>K乙 D.其他条件不变,向容器甲再充入1mol CO,平衡常数(K)不变
|
|||||||||||||||||||||||||||||
| 16. | 详细信息 |
|
在100mL HNO3和H2SO4的混合溶液中,两种酸的物质的量浓度之和为0.6 mol • L-1。向该溶液中加入足量的铜粉,加热,充分反应后,所得溶液中Cu2+的物质的量浓度最大值为(反应前后溶液体积变化忽略不计) A.0.225 mol • L-1 B.0.30 mol • L-1 C.0.36 mol • L-1 D.0.45 mol • L-1
|
|
| 17. | 详细信息 |
|
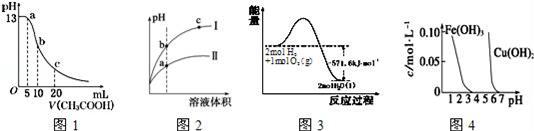
根据下列各图曲线表征的信息,得出的结论不正确的是( )
A.图1表示常温下向体积为10 mL 0.1 mol•L﹣1NaOH溶液中逐滴加入0.1 mol•L﹣1 CH3COOH溶液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH﹣) B.图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中Ⅰ表示醋酸,Ⅱ表示盐酸,且溶液导电性:c>b>a C.图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8 kJ•mol﹣1 D.由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶液中加入适量CuO,调节溶液的pH至4左右
|
|
| 18. | 详细信息 |
|
.下列各组离子在特定条件下一定能够大量共存的是( ) A.含有较多Fe3+的溶液:Na+、SO42﹣、HS﹣、NH4+ B.c(OH﹣)=1mol/L的溶液:AlO2﹣、CH3COO﹣、K+、Ba2+ C.pH=1的溶液:K+、Fe2+、NO3﹣、Na+ D.遇Al能放出H2的溶液:HCO3﹣、K+、Mg2+、Cl﹣
|
|
| 19. | 详细信息 |
|
某课外实验小组设计的下列实验不合理的是( ) A. B. C.
|
|
| 20. | 详细信息 |
|
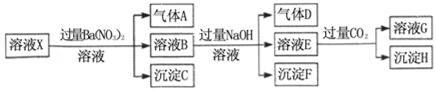
pH=1的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:下列有关推断不正确的是( )
A.溶液X中一定含有H+、Al3+、NH4+、Fe2+、SO42﹣ B.根据上述连续实验不能确定溶液X中是否含有Fe3+、Cl﹣ C.沉淀H为Al(OH)3、BaCO3的混合物 D.若溶液X为100mL,产生的气体A为44.8mL(标准状况),则X中c(Fe2+)=0.06mol•L﹣1
|
|
| 21. | 详细信息 |
|
下列有关问题,与盐的水解有关的是( ) ①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂;②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂; ③草木灰与铵态氮肥不能混合施用;④实验室盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞;⑤加热蒸干AlCl3溶液得到Al(OH)3固体. A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
|
|
| 22. | 详细信息 |
|
锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为: Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是( ) A.电池工作时,锌失去电子,电解液内部OH﹣向负极移动 B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e﹣═Mn2O3(s)+2OH﹣(aq) C.电池工作时,电子由正极通过外电路流向负极 D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
|
|
| 23. | 详细信息 |
|
298K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g)⇌N2O4(g)△H=﹣a kJ/mol (a>0).N2O4的物质的量浓度随时间变化如图.达平衡时,N2O4的浓度为NO2的2倍,若反应在398K进行,某时刻测得n(NO2)=0.6mol、n(N2O4)=1.2mol,则此时,下列大小关系正确的是( )
A.v(正)>v(逆) B.v(正)<v(逆) C.v(正)=v(逆) D.v(正)、v(逆)大小关系不确定
|
|
| 24. | 详细信息 |
|
已知酸H2B在水溶液中存在下列关系:①H2B=H++HB﹣,②HB﹣⇌H++B2﹣,则下列说法中一定正确的是( ) A.在Na2B溶液中一定有:c(OH﹣)=c(H+)+c(HB﹣)+2c(H2B) B.NaHB溶液可能存在以下关系:c(Na+)>c(HB﹣)>c(OH﹣)>c(H+) C.NaHB水溶液中一定有:c(Na+)+c(H+)=c(HB﹣)+c(OH﹣)+c(B2﹣) D.NaHB溶液一定呈酸性,Na2B溶液一定呈碱性
|
|
| 25. | 详细信息 |
|
实验:①0.1molL﹣1AgNO3溶液和0.1molL﹣1NaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c;②向滤液b中滴加0.1molL﹣1KI溶液,出现浑浊;③向沉淀c中滴加0.1molL﹣1KI溶液,沉淀变为黄色. 下列分析不正确的是( ) A.浊液a中存在沉淀溶解平衡:AgCl(s)⇌Ag+(aq)+Cl﹣(aq) B.滤液b中不含有Ag+ C.③中颜色变化说明AgCl转化为AgI D.实验可以证明AgI比AgCl更难溶。
|
|
| 26. | 详细信息 | ||||||
|
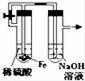
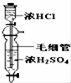
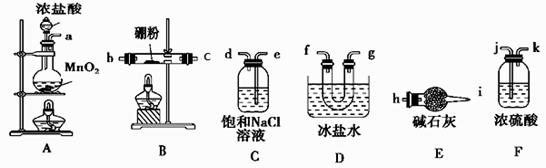
氯气是氯碱工业的主要产品之一,常作强氧化剂,可与有机物和无机物进行反应生成多种氯化物。某兴趣小组在实验室中对以下反应进行了探究。回答下列问题: Ⅰ、三氯化硼(BCl3)的制备,已知:①BCl3的沸点为12.5 ℃,熔点为-107.3 ℃; ②2B+6HCl
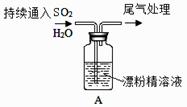
(1)按气流方向连接各装置的接口,顺序为a→( )→( )→( )→( )→( )→( )→f→g→h。 (2)装置D的作用是 ;实验中若不用装置C,可能产生的危险是 。 (3)BCl3遇水发生水解观察到大量的白雾,生成两种酸,其反应的化学方程式为: 。 Ⅱ、SO2与漂粉精溶液的反应
(4)pH试纸颜色的变化说明漂粉精溶液具有的性质是 。 (5)现象2中溶液变为黄绿色的原因是:随溶液酸性的增强,漂粉精的有效成分和Cl- 发生反应。该反应的离子方程式为 。 (6)用离子方程式解释现象3中黄绿色褪去的原因 。
|
|||||||
| 27. | 详细信息 |
|
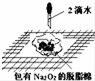
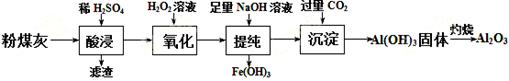
以粉煤灰(主要成分为Al2O3和SiO2,还含有少量的FeO、Fe2O3等)为原料制备Al2O3的流程如下:
(1)“酸浸”时需加入过量的稀硫酸,写出Al2O3溶解的离子方程式 。 (2)证明酸浸后溶液中存在Fe3+的方法是:取酸浸后的溶液少许置于试管中,向其中滴加硫氰化钾溶液,溶液变为血红色;再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去,继续滴加会有气泡逸出,该气体会使带火星的木条复燃。 ①红色变深的原因是(用离子方程式表示): ; ②溶液红色褪去是由于过氧化氢氧化了硫氰根离子,已知双氧水氧化SCN—生成N2、CO2和SO42-,写出该反应的离子方程式: ; ③有气体逸出,说明Fe3+对H2O2的分解有催化作用,写出催化过程第一步反应的离子方程式 。
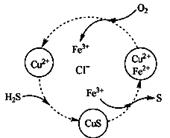
c(SO42-)∶c(Na+)= 。将H2S和空气的混合气体通入 FeCl3 、FeCl2 、CuCl2的混合溶液中反应回收S,其物质转化如 图所示。反应中当有1molH2S转化为硫单质时,保持溶液中Fe3+ 的物质的量不变,需要消耗O2的物质的量为 。 (4)“沉淀”过程中,通入过量CO2时发生反应的化学方程式为 。
|
|
| 28. | 详细信息 |
|
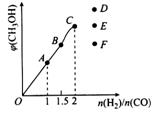
氮和碳的化合物与人类生产、生活密切相关。 (1)已知:N2(g)+O2(g)===2NO(g); ΔH=+180.5 kJ·mol-1 2H2(g)+O2(g)===2H2O(g); ΔH=-483.6 kJ·mol-1 则反应2H2(g)+2NO(g)===2H2O(g)+N2(g);ΔH= 。 (2)在压强为0.1 MPa条件,将CO和H2的混合气体在催化剂作用下转化为甲醇的反应为 CO(g)+2H2(g) ①下列能说明该反应达到平衡状态的是 。 a.混合气体的密度不再变化 b.CO和H2的物质的量之比不再变化 c.v(CO)=v(CH3OH) d.CO在混合气中的质量分数保持不变 ②T1℃时,在一个体积为5 L的恒压容器中充入1 mol CO、2 mol H2,经过5 min达到平衡,CO的转化率为0.75,则T1℃时,CO(g)+2H2(g)
衡时CH3OH的体积分数与n(H2)/n(CO)的关系如图所示。温度不变,当
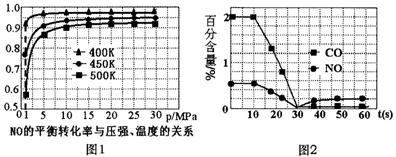
点。 (3)用催化转化装置净化汽车尾气,装置中涉及的反应之一为:2NO(g)+2CO(g)
①探究上述反应中NO的平衡转化率与压强、温度的关系,得到如图1所示的曲线。催化装置比较适合的温度和压强是___________。 ②测试某型号汽车在冷启动(冷启动指发动机水温低的情况下启动)时催化装置内CO和NO百分含量随时间变化曲线如图2所示。则前10 s内,CO和NO百分含量没明显变化的原因是____________。
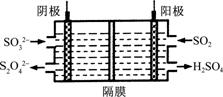
①阳极区的电极反应式为 。 ②阴极排出的溶液中含S2O 无污染气体,同时生成的SO
|
|
| 29. | 详细信息 | |||
|
化学反应原理揭示了不同的物质在水溶液中有不同的行为。请按要求回答下列问题:(已知:H2SO3: Ka1=1. 7×10-2,Ka2=6.0×10-8 ; NH3·H2O:Kb=1.8×10-5) (1)将等物质的量的SO2与NH3溶于水充分反应,所得溶液呈 性,该溶液中各离子浓度由大到小的顺序为: ,所得溶液中c(H+)- c(OH-)= (填写表达式)
(2)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如右图所示(电极材料为石墨)。 ① 图中a极要连接电源的(填“正”或“负”) 极;C口流出的物质是________。 ②
|
||||