2020四川高二上学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
用已知浓度的盐酸滴定未知浓度的NaOH溶液会导致测得的NaOH溶液浓度偏高的是 A.滴定前滴定管中有气泡,滴定后消失 |
|
| 2. | 详细信息 |
|
在10mL 0.1mol·L-1 NaOH溶液中加入同体积、同浓度的CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是 A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) C.c(Na+)=c(CH3COO-)+c(CH3COOH) D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
|
| 3. | 详细信息 |
|
在下列给定条件的溶液中,一定能大量共存的离子组是 A. 无色溶液:K+、Cl- 、Mg2+、 B. C. Na2CO3溶液: K+、Fe3+、 D. 能使pH试纸呈红色的溶液:Na+、 |
|
| 4. | 详细信息 |
|
一定条件下,在体积为10L的密闭容器中,1mol X和1mol Y进行反应:2X(g)+Y(g) A.以Y浓度变化表示的反应速率为0.0005 mol/(L·s) |
|
| 5. | 详细信息 |
|
对于可逆反应:2SO2+O2 A.增大压强 B.升高温度 C.使用催化剂 D.多充O2 |
|
| 6. | 详细信息 |
|
下列各溶液中,微粒的物质的量浓度关系正确的是 A.常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c( B. 0.1mol·L-1 Na2CO3溶液:c(Na+)=c( C. 0.1mol·L-1 NH4Cl溶液:c( D. 向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)=c(CH3COO-)+c(OH-) |
|
| 7. | 详细信息 |
|
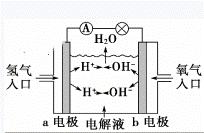
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是
A.a电极是负极 |
|
| 8. | 详细信息 |
|
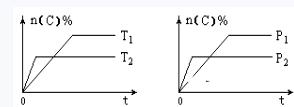
可逆反应aA(g)+bB(s)
A.使用催化剂,C的物质的量分数增加 B.升高温度,平衡向正反应方向移动 C.化学方程式的系数a<c+d D.根据图像无法确定改变温度后平衡移动方向 |
|
| 9. | 详细信息 |
|
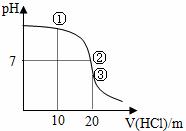
常温下,在20.00mL 0.1000mol·L-1 NH3·H2O溶液中逐滴滴加0.1000mol·L-1HCl溶液,溶液pH随滴入HCl溶液体积的变化曲线如图所示。下列说法正确的是
A.①溶液:c(Cl-)>c( C.①、②、③三点所示的溶液中水的电离程度②>③>① D.滴定过程中不可能出现:c(NH3·H2O)>c( |
|
| 10. | 详细信息 |
|
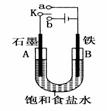
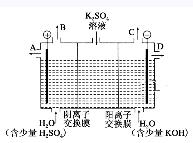
某课外活动小组同学用如图装置进行实验,试回答下列问题: (1)若开始时开关K与a连接,则B极的电极反应式为___________________。 (2)若开始时 总反应的离子方程式为__________________________。 有关上述实验,下列说法正确的是(填序号)_________。 ①溶液中Na+向A极移动 ②从A极处逸出的气体能使湿润KI淀粉试纸变蓝 ③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度 ④若标准状况下B极产生22.4L气体,则溶液中转移2mol电子 (3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为__________________________ 。 此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数 ②通电开始后,阴极附近溶液pH会增大,请简述原因:____________________________。 ③若将制得的氢气、氧气和氢氧化钾溶液组合为氢氧燃料电池,则电池正极的电极反应式为_________。 |
|
| 11. | 详细信息 |
|
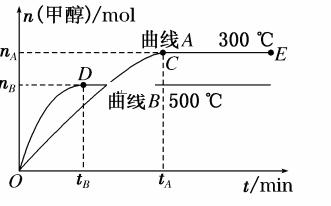
一定条件下,在体积为3L的密闭容器中,一氧化碳与氢气反应生成甲醇(催化剂为Cu2O/ZnO):CO(g)+2H2(g)
(1)反应达到平衡时,平衡常数表达式K=__________,升高温度,K值________(填“增大”“减小”或“不变”),平衡向__________方向移动。 (2)在500 ℃,从反应开始到平衡,氢气的平均反应速率v(H2)____________________。(用含相应字母的式子表示) (3)在其他条件不变的情况下,将处于E点的体系体积压缩到原来的1/2,下列有关该体系的说法正确的是________(填选项字母)。 A.氢气的浓度减小 B.正反应速率加快,逆反应速率也加快 C.甲醇的物质的量增加 D.重新平衡时 (4)据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量CO2有利于维持催化剂Cu2O的量不变,原因是_________________________________(用化学方程式表示)。 |
|
| 12. | 详细信息 | ||||||
|
为证明化学反应有一定的限度,进行如下探究活动: I.取5ml 0.1mol/L的KI溶液,滴加5至6滴FeCl3稀溶液 Ⅱ.继续加入2mlCCl4振荡 Ⅲ.取萃取后的上层清液,滴加KSCN溶液 (1)探究活动I的实验现象为________ 探究活动Ⅱ的实验现象为 __________ (2)为了测定探究活动I中的FeCl3稀溶液的浓度,现进行以下操作: ①移取20.00mLFeCl3稀溶液至锥形瓶中,加入___________用作指示剂,再用c mol/LKI标准溶液进行滴定,达到滴定终点时的现象是 ______ ②重复滴定三次,平均耗用dmol/LKI标准溶液MmL,则FeCl3溶液物质的量浓度为 ___________mol/L ③若滴定前滴定管尖嘴中无气泡,滴定后有气泡,则测定结果_______ (填“偏高”或“偏低”或“不变”)。 Ⅳ.探究活动Ⅲ的意图是通过生成血红色的Fe(SCN)3溶液,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中却未见溶液呈血红色。对此同学们提出了下列两种猜想: 猜想一:Fe3+全部转化为Fe2+ 猜想二:生成的Fe(SCN)3浓度极小,其颜色肉眼无法观察为了验证猜想,查阅资料获得下列信息: 信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大 信息二:Fe3+可与[Fe(CN)6]4—反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高 结合新信息,现设计以下实验方案验证猜想: ①完成下表
②写出实验操作“步骤一”中的反应离子方程式: 。 |
|||||||
| 13. | 详细信息 |
|
为了减少CO对大气的污染,某研究性学习小组拟研究CO和H2O反应转化为绿色能源H2.已知:2CO(g)+O2(g)=2CO2(g) ΔH1=-566kJ·moL−1 2H2(g)+O2(g)=2H2O(g) ΔH2=-483.6kJ·moL−1 H2O(g)=H2O(l) ΔH3=-44.0kJ·moL−1 (1)氢气的标准燃烧热ΔH=______kJ.moL−1. (2)写出CO和H2O(g)作用生成CO2和H2的热化学方程式__________________. (3)往1L体积不变的容器中加入1.00mol CO和1.00mol H2O(g),在t℃ 时反应并达到平衡,若该反应的化学平衡常数K=1,则t℃时CO的转化率为______;反应达到平衡后,升高温度,此时平衡常数将______(填“变大”、“不变”或“变小”),平衡将向______(填“正”或“逆”)方向移动. (4)为了提高CO的转化率,可采取的措施是( ) A.增大的CO浓度 B.增大的H2O(g)浓度 C.使用催化剂 D.降低温度 (5)H2是一种理想的绿色能源,可作燃料电池;若该氢氧燃料电池以KOH为电解质溶液,其负极的电极反应式是______. |
|