2018至2019年高一下学期期末考试化学在线测验完整版(云南省陆良县第八中学)
| 1. 选择题 | 详细信息 |
|
据报道,我国华为公司的技术标准成为世界“5G”通讯标准的重要组成部分。随着“5G”时代的逐渐到来,以光导纤维为基础的信息高速通道更显重要。制造光导纤维的材料是( ) A. 晶体硅 B. 二氧化硅 C. 铜合金 D. 不锈钢 |
|
| 2. 选择题 | 详细信息 |
环境保护十分重要,“绿水青山就是金山银山”。右图是甲、乙、丙、丁四个城市某个时段测得的雨水pH值(纵坐标)图,依据图形判断酸雨最严重的城市是( )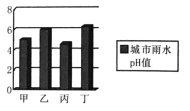 A. 甲 B. 乙 C. 丙 D. 丁 |
|
| 3. 选择题 | 详细信息 |
下列图示的三种实验操作名称从左到右依次是( )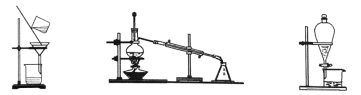 A. 过滤、蒸发、分液 B. 蒸馏、过滤、分液 C. 过滤、蒸馏、分液 D. 分液、蒸馏、过滤 |
|
| 4. 选择题 | 详细信息 |
|
下列化学用语,表达正确的是( ) A. C. CO2的结构式: |
|
| 5. 选择题 | 详细信息 |
|
下列物质中,能使品红溶液褪色的是( ) A. NH3 B. N2 C. CO2 D. SO2 |
|
| 6. 选择题 | 详细信息 |
|
常温下,下列溶液能用铝制容器盛装的是( ) A. 稀硫酸 B. 浓硝酸 C. 盐酸 D. 氢氧化钠的溶液 |
|
| 7. 选择题 | 详细信息 |
|
对铁及其化合物的叙述不正确的是( ) A. 可用KSCN溶液检验Fe3+ B. Fe(OH)2能在空气中稳定存在 C. Fe能从CuSO4溶液中置换出Cu D. Fe2O3与Al可发生铝热反应 |
|
| 8. 选择题 | 详细信息 |
|
当光束通过下列分散系时,能观察到丁达尔效应的是( ) A. CuSO4溶液 B. 硫酸 C. NaCl 溶液 D. Fe(OH)3胶体 |
|
| 9. 选择题 | 详细信息 |
|
化学反应伴随着能量的变化。下列过程中的能量变化不是由化学反应引起的是( ) A. 天然气燃烧 B. 酸碱中和 C. 单质碘升华 D. Ba(OH)2•8H2O晶体与NH4Cl晶体混合并搅拌 |
|
| 10. 选择题 | 详细信息 |
|
下列物质中,含有共价键的是( ) A. CaO B. MgCl2 C. NaCl D. NH4Cl |
|
| 11. 选择题 | 详细信息 |
|
下列各组物质中,互为同位素的是( ) A. O2和O3 B. 石墨和金刚石 C. |
|
| 12. 选择题 | 详细信息 |
|
根据元素周期律的变化规律,下列比较中,正确的是( ) A. 原子半径:Br>Cl>F B. 氧化性:N2>O2>F2 C. 金属性:Al>Mg>Na D. 非金属性:C>N>P |
|
| 13. 选择题 | 详细信息 |
|
以下事实不能用元素周期律解释的是( ) A. Na2CO3的热稳定性强于NaHCO3 B. 氯与钠形成离子键,氯与氢形成共价键 C. 与等浓度的稀盐酸反应,Mg比Al剧烈 D. F2在暗处遇H2即爆炸,I2在暗处遇H2几乎不反应 |
|
| 14. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值。下列说法正确的是( ) A. 16gO2和O3的混合物含有氧原子数为NA B. 1mol H2O含有的质子数为3NA C. 常温常压下,22.4L N2含有的分子数为2NA D. CO2的摩尔质量是44g |
|
| 15. 选择题 | 详细信息 |
|
以下各组离子因发生氧化还原反应而不能大量共存的是( ) A. Ca2+、H+、SO42-、HCO3- B. H+、Fe2+、SO42-、 NO3- C. Na+、Cu2+、Cl-、S2- D. Fe3+、K+、SCN-、Cl- |
|
| 16. 选择题 | 详细信息 |
|
下列离子方程式正确的是( ) A. 硫酸钾溶液与氯化钡溶液的反应:Ba2+ + SO42- === BaSO4↓ B. 铜与氯化铁溶液反应:Cu + Fe3+ === Cu2+ + Fe2+ C. 铁与稀硫酸反应:Fe + 6H+ === Fe3+ + 3H2↑ D. 碳酸钙与稀盐酸反应:CO32- + 2H+ === CO2↑+ H2O |
|
| 17. 选择题 | 详细信息 |
|
根据下列反应: ①2Fe3++2I-===2Fe2++I2 ②Br2+2Fe2+===2Fe3++2Br- 判断相关物质的氧化性由强到弱的顺序是 ( ) A. I- > Fe2+> Br- B. Br2 > Fe3+ > I2 C. Br2 > I2 > Fe3+ D. I2 > Fe3+> Br2 |
|
| 18. 选择题 | 详细信息 |
|
下列各组中的性质比较,正确的是( ) ①酸性:HClO4>H2SO4>H3PO4 ②最高正化合价:Cl>N>C ③稳定性:HCl>HBr>HI ④还原性:HCl>HBr>HI A. ①②④ B. ②③④ C. ①②③ D. 全部都正确 |
|
| 19. 选择题 | 详细信息 |
|
下列金属冶炼的反应原理,不正确的是( ) A. K2O + H2 C. Fe3O4 + 4CO |
|
| 20. 选择题 | 详细信息 |
如图表示化学反应过程中的能量变化,据图判断下列说法中合理的是( )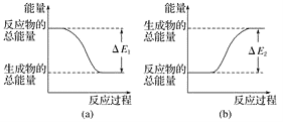 A. 500 mL 2.0 mol·L-1HCl溶液和500 mL 2.0 mol·L-1NaOH溶液的反应符合图(a),且放出热量为ΔE1 B. 500 mL 2.0 mol·L-1H2SO4溶液和500 mL 2.0 mol·L-1Ba(OH)2溶液的反应符合图(b),且吸收热量为ΔE2 C. 发生图(a)能量变化的任何反应,一定不需要加热即可发生 D. CaO、浓硫酸分别溶于水时的能量变化均符合图(a) |
|
| 21. 选择题 | 详细信息 |
|
一种“既热即食型”快餐适合外出旅行时使用,它是利用两种物质发生化学反应对食物进行加热,这两种化学物质最适合选择的是( ) A. 浓硫酸与水 B. 氢氧化钠与水 C. 生石灰与水 D. 氯化钠与水 |
|
| 22. 选择题 | 详细信息 |
|
下列热化学方程式书写正确的是(△H的绝对值均正确)( ) A. 2NO2 = O2 + 2NO △H=+116.2kJ/mol(反应热) B. NaOH(aq)+HCl(aq)= NaCl(aq)+H2O(l) △H=+57.3 kJ/mol(中和热) C. C2H5OH(l)+3O2(g)= 2CO2(g)+3H2O(g) △H=﹣1367.0 kJ/mol(燃烧热) D. S(s)+O2(g)= SO2(g) △H=﹣296.8 kJ/mol(反应热) |
|
| 23. 选择题 | 详细信息 |
|
科学、可持续、和谐利用资源是习.平建立新时代中国特色社会主义思想的重要组成部分。下列有关资源开发和利用的说法不正确的是( ) A. 从海水中可以制取镁、钾、溴及其化工产品 B. 通过石油裂化和裂解可以得到乙烯等重要化工原料 C. 以石油、煤、天然气为原料,可获得性能优异的高分子材料 D. 金属冶炼常会消耗很多能量,也易造成环境污染,应该停止使用金属材料 |
|
| 24. 选择题 | 详细信息 |
|
向一定量的Fe、FeO、Fe3O4的混合物中加入100mL2mol/L的盐酸,恰好使混合物完全溶解,放出224mL(标准状况)的气体,所得溶液中加入KSCN溶液无血红色出现。若用足量的CO在高温下还原相同质量的此混合物,能得到铁的质量是( ) A. 11.2g B. 5.6g C. 2.8g D. 无法计算 |
|
| 25. 推断题 | 详细信息 |
下表是元素周期表的一部分,其中每个数字编号代表一种短周期元素。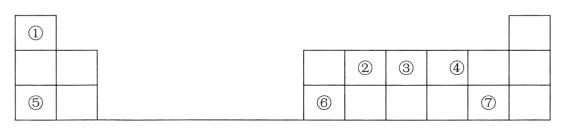 请按要求回答下列问题: (1)元素②的元素名称是_________;元素⑥的元素符号是___________。 (2)元素⑤处于周期表中第_____周期第______族。 (3)①~⑦七种元素中原子半径最大的是_________(填元素符号)。②③④三种元素的最简单氢化物中最稳定的是_________________(填化学式)。 (4)元素③和元素⑦的氢化物均极易溶于水,且二者能反应产生大量白烟,写出该反应的化学方程式______________。 (5)元素⑥的最高价氧化物对应的水化物是一种_____性氢氧化物,该物质与元素⑦的最高价氧化物对应水化物反应的离子方程式为_________。 |
|
| 26. 填空题 | 详细信息 |
|
(1)已知:TiO2(s)+2Cl2 (g)+2C(s)=TiCl4(l)+2CO(g) △H=-81 kJ·mol-1 2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1 写出TiO2和Cl2反应生成TiCl4和O2的热化学方程式:______________________。 (2)铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。高炉炼铁是冶炼铁的主要方法,发生的主要反应为: Fe2O3(s)+3CO(g) 已知: ①Fe2O3(s)+3C(石墨) = 2Fe(s)+3CO(g) ΔH1 = + 489.0 kJ mol-1 ②C(石墨)+CO2(g) = 2CO(g) ΔH2 = + 172.5 kJ mol-1 则a =______kJ mol-1。 |
|
| 27. 推断题 | 详细信息 |
已知:单质A为目前人类使用最广泛的金属,氧化物B为具有磁性的黑色晶体,根据下列转化关系填空。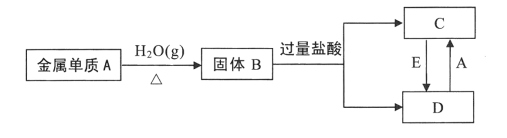 (1)试判断:A的化学式为_____________,B的名称为_______________。 (2)实验室检验C溶液中的阳离子时,可加入氢氧化钠溶液,若先产生___________色沉淀,该沉淀在空气中迅速变为灰绿色,最终变为_________色,则含该离子。 (3)实验室检验D溶液中的阳离子时,通常可滴加_________,若溶液变为_______色,则含该离子。 (4)若E是一种黄绿色气体单质,该气体是________________,在C→D过程中,此气体做_________剂。 (5)写出固体B与过量盐酸反应的离子方程式__________________________。 (6)写出D + A→C的离子方程式__________________________。 |
|
| 28. 计算题 | 详细信息 |
2SO2(g)+O2(g) =2SO3(g)反应过程的能量变化如图所示。已知1mol SO2(g)氧化为1mol SO3的ΔH=-99kJ·mol-1.请回答下列问题: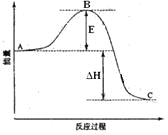 (1)图中A、C分别表示______、______,E的大小对该反应的反应热有无影响?_______。该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?________,理由是________________________; (2)图中△H=__KJ·mol-1; (3)已知单质硫的燃烧热为296 KJ·mol-1,计算由S(s)生成3 molSO3(g)的△H__(要求写计算过程)。 |
|
| 29. | 详细信息 |
镁及其合金是一种用途广泛的金属材料,目前世界上60%的镁是从海水中提取的。主要步骤如下: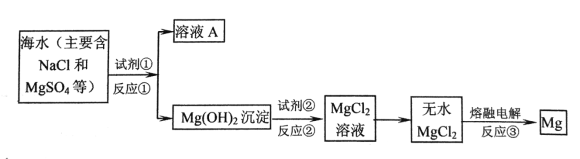 (1)镁在元素周期表中位于第__________周期,第___________族。 (2)为使MgSO4完全转化为Mg(OH)2沉淀,试剂①可选用____________(填化学式),且加入试剂①的量应______________(选填“少量”或“过量”)。 (3)若要检验溶液A中含有的SO42-,使用的试剂是_________________。 (4)加入试剂①后,分离得到Mg(OH)2沉淀的方法是__________。试剂②可以选用_______。 (5)反应①、反应②、反应③属于氧化还原反应类型的是________。 (6)工业上常用电解熔融MgCl2的方法冶炼得到金属Mg,写出该反应的化学方程式__________。 |
|
| 30. 计算题 | 详细信息 |
|
一块表面被氧化的钠,投入足量水中充分反应,放出3.36L(标准状况)的气体,该气体在电火花下刚好完全反应;测得反应后溶液的体积为200mL,此溶液与100mL6mol/L的盐酸恰好完全中和。试计算(简要写出计算过程): (1)反应所得NaOH溶液的物质的量浓度是多少______? (2)该表面被氧化的钠各成分的质量是多少g______? |
|
高中化学 试卷推荐
最近更新



