2018-2019年高二上期期中考试化学试卷(黑龙江省牡丹江市第三高级中学)
| 1. 选择题 | 详细信息 |
|
可以用分液漏斗进行分离的混合物是 A. 酒精和碘水 B. 苯和水 C. 乙酸和乙酸乙酯 D. 乙酸和水 |
|
| 2. 选择题 | 详细信息 |
|
为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序是 ①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 A. ①④①②⑤③ B. ①②⑤④①③ C. ①②④⑤③ D. ④②⑤ |
|
| 3. 选择题 | 详细信息 |
|
下列叙述中正确的是 A. 摩尔是物质的质量的单位 B. 碳的摩尔质量为12g C. 阿伏加德罗常数约为6.02×1023mol-1 D. 一个碳原子的质量为12g |
|
| 4. 选择题 | 详细信息 |
|
下列物质中所含氢原子数最多的是( ) A. 2mol CH4 B. 3mol NH3 C. 4mol H2O D. 6mol HCl |
|
| 5. 选择题 | 详细信息 |
|
下列分散系,能产生丁达尔效应的是 ( ) A. Na2SO4溶液 B. Fe(OH)3胶体 C. FeCl3溶液 D. NaOH溶液 |
|
| 6. 选择题 | 详细信息 |
|
下列离子方程式正确的是 A. 钠和冷水反应 Na+2H2O = Na++2OH—+H2↑ B. 铁粉投入到硫酸铜溶液中:2 Fe+3Cu2+ = 2 Fe3++3Cu C. AlCl3溶液中加入足量的氨水:Al3++ 3OH- = Al(OH)3↓ D. 稀盐酸滴在石灰石上:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ |
|
| 7. 选择题 | 详细信息 |
|
下列离子在溶液中能大量共存的是 A.Ba2+、SO42- 、K+、 OH- B.Na+ 、H+、NO3-、SO42- C.Al3+、HCO3- 、K+、 OH- D.Fe2+、NH4+、Cl-、OH- |
|
| 8. 选择题 | 详细信息 |
|
8NH3 + 3Cl2 ===6NH4Cl + N2,反应中氧化剂和还原剂的质量比是( ) A. 8 :3 B. 213 :136 C. 34 :213 D. 213 :34 |
|
| 9. 选择题 | 详细信息 |
|
既能与盐酸反应又能与氢氧化钠溶液反应的物质是( ) A. Al2O3 B. Fe2O3 C. AlCl3 D. Cu |
|
| 10. 选择题 | 详细信息 |
|
下列关于钠的说法中错误的是 A. 钠可以从硫酸铜溶液中还原出铜单质 B. 钠元素以化合态存在于自然界中 C. 钠在氯气中燃烧产生大量的白烟 D. 金属钠有强还原性 |
|
| 11. 选择题 | 详细信息 |
|
“3G”手机出现后,以光导纤维为基础的高速信息通道尤显重要。下列物质中用于制造光导纤维的材料是 A. 铜合金 B. 陶瓷 C. 聚乙烯 D. 二氧化硅 |
|
| 12. 选择题 | 详细信息 |
|
关于氯气的叙述中,下列说法正确的是 A. 氯气是一种黄绿色、有毒的气体 B. 氯气可以与铁反应生成FeCl2 C. 氯气不能溶于水,所以可用排水法收集氯气 D. 氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物 |
|
| 13. 选择题 | 详细信息 |
|
下列说法中错误的是( ) A. 二氧化硫能漂白某些物质,说明它具有氧化性 B. 二氧化硫的水溶液中滴加氯化钡无现象,再加入0.5mL3%的过氧化氢后产生沉淀 C. 将足量二氧化硫通入酸性高锰酸钾溶液中,溶液褪色,不能说明二氧化硫具有漂白性 D. 二氧化硫漂白过的草帽过一段时间后变黄 |
|
| 14. 选择题 | 详细信息 |
|
下列操作不能用于检验NH3的是 A. 气体使湿润的酚酞试纸变红 B. 气体能使湿润的红色石蕊试纸变蓝 C. 气体与浓H2SO4靠近 D. 气体与浓盐酸产生白烟 |
|
| 15. 选择题 | 详细信息 |
|
区分强电解质和弱电解质的依据是( ) A. 溶解度的大小 B. 属于离子化合物还是共价化合物 C. 是否存在电离平衡 D. 导电性的强弱 |
|
| 16. 选择题 | 详细信息 |
|
下列事实可证明氨水是弱碱的是 ( ) A. 氨水能跟氯化亚铁溶液反应生成氢氧化亚铁 B. 铵盐受热易分解 C. 0.1mol/L氨水可以使酚酞试液变红 D. 0.1mol/L氯化铵溶液的pH为5 |
|
| 17. 选择题 | 详细信息 |
|
某学生的实验报告所列出的下列数据中合理的是( ) A. 用10mL量筒量取7.13mL稀盐酸 B. 用pH计测得某稀盐酸的pH为1.54 C. 用碱式滴定管量取烧碱溶液20.3 mL D. 用托盘天平称得某物质的质量为13.15g |
|
| 18. 选择题 | 详细信息 |
|
下列有关滴定操作的顺序正确的是:①用标准溶液润洗滴定管;②往滴定管内注入标准溶液;③检查滴定管是否漏水;④滴定;⑤洗涤( ) A. ③⑤①②④ B. ⑤①②③④ C. ⑤②③①④ D. ②①③⑤④ |
|
| 19. 选择题 | 详细信息 |
|
在0.1mol/L的CH3COOH溶液中,要促进醋酸电离且氢离子浓度增大,应采取的措施是( ) A. 升温 B. 降温 C. 加入NaOH溶液 D. 加入稀HCl |
|
| 20. 选择题 | 详细信息 |
|
pH值相同的下列溶液,其物质的量浓度最大的是( ) A. HCl B. H2SO4 C. CH3COOH D. H3PO4 |
|
| 21. 选择题 | 详细信息 |
|
下列溶液加热蒸干后并灼烧,能得到原溶质固体的是( ) A. AlCl3 B. NaHCO3 C. FeSO4 D. K2SO4 |
|
| 22. 选择题 | 详细信息 |
|
要除去MgCl2酸性溶液中少量的FeCl3,不宜选用的试剂是( ) A. MgO B. MgCO3 C. NaOH D. Mg(OH)2 |
|
| 23. 选择题 | 详细信息 |
|
在20mL0.1mol·L-1HCl溶液中加入同体积、同物质的量浓度的NH3·H2O溶液,反应后溶液中各粒子浓度的关系错误的是( ) A. C(H+)+C(NH4+)=C(OH-)+C(Cl-) B. C(H+)= C(OH-)+ C(NH 3·H2O) C. C(Cl-)>C(NH4+)>C(OH-)>C(H+) D. C(Cl-)=C(NH4+)+ C(NH 3·H2O) |
|
| 24. 选择题 | 详细信息 |
|
把氢氧化钙放入蒸馏水中,一定时间后达到下列溶解平衡:Ca(OH)2 (s) A. CaCl2 B. NaHCO3 C. NaOH D. NaCl |
|
| 25. 选择题 | 详细信息 |
|
有一合金由X、Y、Z、W四种金属组成,若将合金放入盐酸中只有Z、Y能溶解;若将合金置于潮湿空气中,表面只出现Z的化合物;若将该合金做阳极,用X盐溶液作电解液,通电时四种金属都以离子形式进入溶液中,但在阴极上只析出X。这四种金属的活动性顺序是 A. Y>Z>W>X B. Z>Y>W>X C. W>Z>Y>X D. X>Y>Z>W |
|
| 26. 选择题 | 详细信息 |
|
为了保护地下钢管不受腐蚀,可使它与( ) A.直流电源负极相连 B.铜板相连 C.锡板相连 D.直流电源正极相连 |
|
| 27. 选择题 | 详细信息 |
|
下列有关问题,与盐的水解有关的是( ) ①NH4Cl溶液可做焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可做泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤加热蒸干AlCl3溶液得到Al(OH)3固体 ⑥用热的Na2CO3溶液去污 ⑦使用明矾净水 ⑧贮存FeCl3溶液滴加几滴盐酸. A. ①②③⑤ B. ②③④⑥⑧ C. ①④⑤⑦⑧ D. 全部 |
|
| 28. 选择题 | 详细信息 |
关于下列各装置图的叙述中,正确的是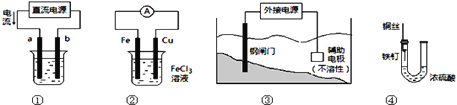 A. 用装置①精炼铜,则b极为粗铜,电解质溶液为CuSO4溶液 B. 装置②的总反应是:Cu+2Fe3+=Cu2++2Fe2+ C. 装置③中钢闸门应与外接电源的正极相连 D. 装置④中的铁钉几乎没被腐蚀 |
|
| 29. 填空题 | 详细信息 |
|
I.炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红褐色锈斑。请回答: (1)铁锅的锈蚀是________腐蚀(填“析氢”或“吸氧”)。 (2)写出铁锅腐蚀正极的电极反应式:_______________ II.在如图用石墨作电极的电解池中,放入500mL饱和NaCl溶液并滴入酚酞,进行电解,观察到B电极附近溶液先变红。请回答下列问题:  (1)A接的是电源的_______极,B是该装置______。 (2)写出电解时总反应的离子方程式:____________________________ 。 (3)电解后溶液的pH______ ;(填 增大、减小或不变)要使电解后溶液恢复到电解前的状态,则需加入_______ 。 (4)若电源为碱性锌锰干电池,负极为______ 正极为______ 电解质溶液是_______ |
|
| 30. 填空题 | 详细信息 |
|
(1)工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,反应的化学方程式_____________漂白粉的有效成分是__________(填化学式)。 (2)实验室制取氨气的化学方程式:__________________________________ (3)1.2gRSO4中含0.01molR2+,则RSO4的摩尔质量是______________; (4)实验室制Fe(OH)2一般看不到白色的Fe(OH)2沉淀,原因___________________现象是:_________________________ 。反应的化学方程式:__________________________________ (5)碳酸钠水解反应的离子方程式(第一步):_________________________ 。 (6)铅蓄电池的负极反应式:_________________________ 。 (7)硫酸钡的沉淀溶解平衡:__________________________________。 |
|
| 31. 填空题 | 详细信息 |
|
现有浓度均为0.010 mol/L的下列溶液: ①硫酸 ②醋酸 ③氢氧化钠 ④氯化铵 ⑤硫酸铝 ⑥碳酸氢钠。请回答下列问题: (1)写出②电离方程式___________此电离反应的电离平衡常数K==1.75×10-5则Ⅰ.当向溶液中加入一定量的盐酸是,K的数值是否发生变化_______填“变”或“不变”)原因_______________________________________________ Ⅱ.若②的起始浓度还是0.010mol/L,平衡时氢离子浓度为:_____________mol/L(已知:17.5开方的值为4.18) (2)写出③与⑤混合当③过量时的离子反应的方程式______________________ (3)已知T℃,Kw = 1×10-13,则T℃_______25℃(填“>”、“<”、“=”); (4)①②③④四种溶液中由水电离出的H+浓度由大到小的顺序是__________(填序号)。 (5)写出④的水解的离子方程式___________________________________ (6)25℃0.005 mol/L的①溶液,pH=____,溶液中由水电离出的c(H+)=________mol/L |
|
| 32. 实验题 | 详细信息 |
|
某烧碱溶液中含有少量杂质(不与盐酸反应),现用中和滴定测定其浓度。 (1)用_______式滴定管盛装c mol/L盐酸标准液。配制c mol/L盐酸标准液,必须使用的主要容器是____________ 如图表示某次滴定时50 mL滴定管中前后液面的位置。滴定管读数时应注意____________________________________。尖嘴部分应____________________________。用去的标准盐酸的体积是_____________mL  (2)该实验应选用_____作指示剂;操作中如何确定终点?______________________________。 (3)对下列两种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”) a.若滴定前用蒸馏水冲洗锥形瓶,则会使测定结果__________; b.若在滴定过程中不慎将数滴酸液滴在锥形瓶外,则会使测定结果__________; |
|
最近更新



