四川省内江市2020-2021年高一上半年期末检测化学题带参考答案
| 1. 选择题 | 详细信息 |
|
化学研究最重要的方法是 A.观察法 B.实验法 C.推理法 D.计算法 |
|
| 2. 选择题 | 详细信息 |
|
化学与生产、生活及社会发展密切相关。下列有关说法错误的是 A.司母戊鼎、飞机外壳和石灰石均属于合金 B.高纯度的硅单质广泛用于制作半导体材料和太阳能电池 C.铁盐和铝盐均可用于净水 D.利用焰色反应可制成节日烟花 |
|
| 3. 选择题 | 详细信息 |
|
国家卫健委公布的新型冠状病毒肺炎诊疗方案指出,乙醚、75%乙醇、含氯消毒剂、过氧乙酸(CH3COOOH)、氯仿(CHCl3)等均可有效灭活病毒。对于上述有关药品,下列说法错误的是 A.乙醇能与水以任意比例互溶 B.NaClO通过氧化灭活病毒 C.过氧乙酸摩尔质量为76 D.乙醚和氯仿均有毒,使用时应注意防护 |
|
| 4. 选择题 | 详细信息 |
|
下列有关实验操作的说法正确的是 A.用容量瓶配制溶液时,摇匀后发现液面低于刻度线,立即加水至刻度线 B.进行分液操作时,先从分液漏斗上口倒出上层液体,后通过下端活塞放出下层液体 C.往沸水中滴加饱和氯化铁溶液制备氢氧化铁胶体时,要边滴溶液边搅拌防止溶液飞溅 D.蒸馏时温度计水银球应位于蒸馏烧瓶支管口处 |
|
| 5. 选择题 | 详细信息 |
|
下列叙述正确的是 A.卤水点豆腐和静电除尘都应用了胶体聚沉的性质 B.溶液和胶体的本质区别是能否产生丁达尔效应 C.合金的熔点一般比组成成分的金属熔点低 D.树状分类法是唯一能表示物质分类的方法 |
|
| 6. 选择题 | 详细信息 | |||||||||||||||||||||||||
下列组合正确的是
|
||||||||||||||||||||||||||
| 7. 选择题 | 详细信息 |
|
下列实验装置或操作与微粒的大小无直接关系的是( ) A.过滤  B.渗析 B.渗析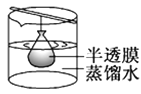 C.萃取  D.丁达尔效应 D.丁达尔效应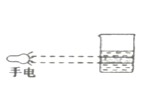 |
|
| 8. 选择题 | 详细信息 |
某国外化学教材中有一张关于氧化还原反应的插图(如下图所示),由图可知 在该反应中 在该反应中 A.作氧化剂 B.被氧化 C.发生还原反应 D.是还原产物 |
|
| 9. 选择题 | 详细信息 |
|
下列物质既能与盐酸又能与氢氧化钠溶液反应的是 A.Cu B.Fe2O3 C.Al2O3 D.Na2CO3 |
|
| 10. 选择题 | 详细信息 |
|
室温下,下列各组离子在指定溶液中能大量共存的是 A.NaOH溶液:Na+、K+、CO B.FeSO4溶液:H+、Mg2+、Cl-、NO C.KHCO3溶液:Na+、Cl-、SO D.H2SO4溶液:K+、Ba2+、NO |
|
| 11. 选择题 | 详细信息 |
如图所示,是某反应的微观示意图,下列有关说法正确的是 A.生成的物质都是氧化物 B.反应物都刚好完全反应 C.该反应的基本类型属于置换反应 D.反应方程式为2H2S+4O2 |
|
| 12. 选择题 | 详细信息 | |||||||||||||||
喷泉实验装置如图所示。应用下列各组气体与溶液,能出现喷泉现象的是
|
||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列离子方程式书写正确的是 A.三氯化铁溶液中加入铁粉:Fe3++Fe=Fe2+ B.氯气通入水中:Cl2+H2O=2H++ClO-+Cl- C.氢氧化铜与稀盐酸反应:Cu(OH)2+2H+=Cu2++2H2O D.碳酸氢钠溶液与烧碱溶液混合:HCO |
|
| 14. 选择题 | 详细信息 |
|
某白色固体混合物由NaCl、KCl、MgSO4、CaCO3中的两种组成,进行如下实验:① 混合物溶于水,得到澄清透明溶液;② 做焰色反应,通过钴玻璃可观察到紫色;③ 向溶液中加碱,产生白色沉淀。根据实验现象可判断其组成为 A.KCl、NaCl B.KCl、MgSO4 C.KCl、CaCO3 D.MgSO4、NaCl |
|
| 15. 选择题 | 详细信息 |
|
下列物质间的转化能通过一步反应实现的是 A.NH3→NO B.Al2O3→Al(OH)3 C.SiO2→H2SiO3 D.Cu→Cu(OH)2 |
|
| 16. 选择题 | 详细信息 | |||||||||||||||
对下列事实的原因分析正确的是
A.A B.B C.C D.D |
||||||||||||||||
| 17. 选择题 | 详细信息 | ||||||||||||||||||||
除去下列物质中的杂质,所用试剂和方法正确的是
A.A B.B C.C D.D |
|||||||||||||||||||||
| 18. 选择题 | 详细信息 |
|
设NA为阿伏加德罗常数的值,则下列叙述中正确的是 A.25℃,101 kPa时,22.4 L氮气中含有原子数为2NA B.常温常压下,O2和O3的混合物共64 g,所含氧原子数目一定为4NA C.2.3gNa与O2完全反应,转移的电子数为0.2NA D.1mol/L的Na2CO3溶液中含2NA个Na+ |
|
| 19. 选择题 | 详细信息 |
|
某溶液中大量存在以下五种离子:MnO A.Ag+ B.Fe2+ C.CO |
|
| 20. 选择题 | 详细信息 |
|
亚硝酸钠(NaNO2)具有致癌作用,许多腌制食品中含NaNO2.酸性KMnO4溶液与亚硝酸钠反应的离子方程式为:MnO A.生成1 mol Mn2+,转移电子为5 mol B.该反应中氮元素被氧化 C.配平后,水的化学计量数为6 D.反应中氧化剂与还原剂的物质的量之比为2:5 |
|
| 21. 选择题 | 详细信息 |
|
工业上冶炼钼的化学原理为 ①2MoS2+7O2 ②MnO3+2NH3·H2O=(NH4)2MoO4+H2O ③(NH4)2MoO4+2HCl=H2MoO4↓+2NH4Cl ④H2MoO4 ⑤用还原剂将MoO3还原成金属钼。则下列说法中错误的是 A.MoS2煅烧产生的尾气不可以直接排到空气中 B.MoO3是金属氧化物,也是碱性氧化物 C.H2MoO4热稳定性差 D.利用H2、CO分别还原等量的MoO3,所消耗还原剂的物质的量之比为1:1 |
|
| 22. 填空题 | 详细信息 |
|
现有下列八种物质: ①稀硫酸 ②小苏打 ③水玻璃 ④二氧化碳 ⑤Na ⑥NaOH溶液 ⑦Na2O2 ⑧Al (1)上述物质中有两种物质在水溶液中反应的离子方程式为:H++OH-=H2O,这两种物质的序号是_______(填序号)。 (2)上述物质中有两种物质可用于呼吸面具或潜水艇中制备氧气,该反应的化学方程式是_______。 (3)上述物质中既能与HCl又能跟NaOH反应的物质是_______(填序号)。 (4)向③中通入CO2,会出现软而透明的凝胶胶体,其化学方程式是_______。 (5)②可用于治疗胃酸过多,其原理是_______(用离子方程式表示)。 (6)⑤需密封保存,其中一个目的是与水隔离,原因是_______(用化学方程式表示)。 (7)用18.4 mol/L的浓硫酸配制500 mL 0.5mol/L的①,所需主要仪器除量筒、烧杯、玻璃棒、胶头滴管外,还需要_______,定容时由于仰视刻度线,则对所配溶液浓度产生的影响为_______(填“偏大”、“偏小”或“无影响”)。 |
|
| 23. 实验题 | 详细信息 | |
新冠肺炎疫情期间,环境消毒是极其关键的,常常喷洒“84”消毒液,其有效成分为NaClO。实验室利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。 回答下列问题: (1)盛放浓盐酸的仪器名称是_______。 (2)a的作用是_______。 (3)b中采用的加热方式是_______,c中发生反应的离子方程式是_______。 (4)d中可选用试剂_______(填标号)。 A.Na2SO3溶液 B.NaCl溶液 C.NaOH溶液 D.稀H2SO4 (5)反应结束后,取出b中试管,经冷却、结晶、_______、_______及干燥,得到KClO3晶体。 (6)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1号试管溶液颜色不变,2号试管溶液变为棕色,可知该条件下NaClO的氧化能力_______KClO3(填“大于”或“小于”)。 (7)已知某“84”消毒液瓶体部分标签如图所示,该“84”消毒液通常用水稀释100倍(体积之比)后使用。用水稀释后的溶液中c(Na+)=_______mol/L。(保留到小数点后两位)
|
||
| 24. 填空题 | 详细信息 |
|
铁及其化合物在生产、生活中有着广泛的应用。 (1)钢(一种铁碳合金)是用量最大、用途最广的合金。钢的硬度比纯铁_______(填“大” 或“小”)。 (2)高铁酸钾(K2FeO4)是一种新型高效、无毒的多功能水处理剂,K2FeO4中Fe的化合价为_______。 (3)若一定量的普通铁粉和水蒸气在高温下反应生成44.8 LH2(标准状况),则转移电子的物质的量为_______mol。 (4)FeSO4可作补血剂,用于治疗缺铁性贫血症。用FeSO4溶液制备Fe(OH)2的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下,再挤出NaOH溶液。这样操作的目的是_______。 (5)印刷电路板是由高分子材料和铜箔复合而成,刻制印刷电路时,要用FeCl3溶液作为“腐蚀液”,该反应的离子方程式为_______,检验反应后的溶液中是否还有三价铁离子的试剂是_______。 (6)聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:  ①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_______。 ②酸浸时,通入O2的目的是_______。 ③“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+,再用酸性K2Cr2O7,标准溶液测定Fe2+的量(Cr2O |
|
| 25. 填空题 | 详细信息 |
氮氧化合物和二氧化硫是引起雾霾重要物质,工业用多种方法来治理。某种综合处理含NH 已知:NO+NO2+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO3+NaNO2+H2O (1)NO是_______色的气体,_______(填“易”或“难”)溶于水;NO在空气中很容易被氧化成NO2,NO2能与水发生化学反应,写出NO2与水反应的化学方程式为_______。 (2)SO2造成的一种常见的环境污染为_______。 (3)固体1的主要成分有Ca(OH)2、_______、_______(填化学式)。 (4)用NaNO2溶液处理含NH (5)验证废水中NH (6)捕获剂捕获的气体主要是_______(填化学式)。 (7)流程中生成的NaNO2因外观和食盐相似,又有咸味,容易使人误食中毒。已知NaNO2能发生如下反应: 2NaNO2+4HI=2NO↑+I2+2NaI+2H2O,I2可以使淀粉溶液变蓝。根据上述反应,选择生活中常见的物质和有关试剂进行实验,以鉴别NaNO2和NaCl固体。需选用的物质是_______(填序号)。 ①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋 |
|
最近更新



