莆田第二十五中学2020年高二化学下半期月考测验在线答题
| 1. 选择题 | 详细信息 |
|
美国科学家将两种元素铅和氪的原子核对撞,获得了一种质子数为118、质量数为293的超重元素,该元素原子核内的中子数和核外电子数之差为 ( ) A.57 B.47 C.61 D.293 |
|
| 2. 选择题 | 详细信息 |
|
在 A. 能量最低原理 B. 泡利不相容原理 C. 原子轨道能级图 D. 洪特规则 |
|
| 3. 选择题 | 详细信息 |
|
北京“鸟巢”运用了高强度、高性能的钒氮合金高新钢,钒元素的原子序数为23,则钒原子的外围电子排布式正确的是( ) A.3s23p6 B.3d34s2 C.3d64s2 D.4s2 |
|
| 4. 选择题 | 详细信息 |
|
下列基态原子或离子的电子排布式错误的是( ) A. K:1s22s22p63s23p64s1 B. F-:1s22s22p6 C. Fe:1s22s22p63s23p63d54s3 D. Kr:1s22s22p63s23p63d104s24p6 |
|
| 5. 选择题 | 详细信息 |
|
下列物质的分子中,没有π键的是( ) A. CO2 B. N2 C. CH≡CH D. HClO |
|
| 6. 选择题 | 详细信息 |
|
下列物质的晶体中,不存在分子的是( ) A. 二氧化硅 B. 二氧化硫 C. 二氧化碳 D. 二硫化碳 |
|
| 7. 选择题 | 详细信息 |
|
下列共价键的键能最大的是( ) A. H—F B. H—O C. H—N D. H—C |
|
| 8. 选择题 | 详细信息 |
|
在下列元素的基态原子中,其最外电子层未成对电子最多的是( ) A.Cl B.P C.Al D.Si |
|
| 9. 选择题 | 详细信息 | ||||||||||||||
某元素的第一电离能至第七电离能
|
|||||||||||||||
| 10. 选择题 | 详细信息 |
|
碳化硅(SiC)的一种晶体具有类似金刚石的结构,其中碳原子和硅原子的位置是交替的。在下列三种晶体①金刚石 ②晶体硅 ③碳化硅中它们的熔点,从高到低的顺序是( ) A. ①③② B. ②③① C. ③①② D. ②①③ |
|
| 11. 选择题 | 详细信息 |
|
碳家族的新成员C60,它具有空心的类似足球的结构,被称为足球烯,下列有关C60的说法正确的是( ) A.C60是一种新型的化合物 B.C60和石墨都是碳的同分异构体 C.C60中含有非极性键,是原子晶体 D.C60相对分子质量为720 |
|
| 12. 选择题 | 详细信息 |
|
下列分子的稳定性的比较正确的是( ) A. HF>HI B. CH4<SiH4 C. PH3>NH3 D. H2O<H2S |
|
| 13. 选择题 | 详细信息 |
|
某潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是( ) A. 原子半径:Al>Na B. 第一电离能:Al<Na C. 硬度:Na>Al D. 基态原子未成对电子数:Na=Al |
|
| 14. 选择题 | 详细信息 |
某晶体中含有A、B、C三种元素,其排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )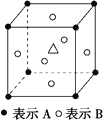 A. 1∶3∶1 B. 2∶3∶1 C. 8∶6∶1 D. 4∶3∶1 |
|
| 15. 选择题 | 详细信息 |
|
下列有关离子晶体的数据大小比较不正确的是( ) A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO |
|
| 16. 选择题 | 详细信息 |
|
下列化学用语的表达正确的是 A.原子核内有10个中子的氧原子: B.氯原子的结构示意图: C.Fe3+的最外层电子排布式:3s23p63d5 D.基态铜原子的价层电子排布图: |
|
| 17. 选择题 | 详细信息 |
|
下列判断与分子间作用力无关的是( ) A.熔点:H2O>H2S B.NH3易液化 C.CH3CH2OH易溶于水 D.HI易分解 |
|
| 18. 选择题 | 详细信息 |
已知某离子晶体的晶胞如图所示,其摩尔质量为Mg/mol,阿伏加德罗常数的值为NA,晶体的密度为dg/cm9。下列关于该晶体的说法正确的是( )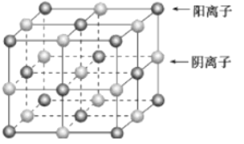 A.晶胞中阴、阳离子的个数都为1 B.阴、阳离子的配位数都是4 C.该晶胞可能是NaCl的晶胞 D.该晶体中两个距离最近的阳离子的核间距为  |
|
| 19. 填空题 | 详细信息 |
|
A、B、C、D、E代表5种元素。请填空: (1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为____。 (2)B元素的负一价离子和C元素的正一价离子的电子层结构都与氩相同,B的元素符号为___,C的元素符号为________。 (3)D元素的正三价离子的3d原子轨道为半充满,D的元素符号为___,其基态原子的电子排布式为____________。 (4)E元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,E的元素符号为___,其基态原子的电子排布式为______________。 |
|
| 20. 推断题 | 详细信息 |
|
A、B、C、D四种元素处于同一短周期,在同族元素中,A的气态氢化物的沸点最高,B的最高价氧化物对应的水化物的酸性在同周期中是最强的,C的电负性介于A、B之间,D与B相邻。 (1)C的原子的外围电子排布式为_____。 (2)在B的单质分子中存在__个π键,____个σ键。 (3)已知B的气态氢化物很容易与H+结合,B原子与H+间形成的化学键叫______ (4)在A、B、C、D四种元素形成的电子数相同的四种氢化物中沸点最低的是____(写分子式),其沸点显著低于其他三种氢化物的原因是:_________。 |
|
| 21. 填空题 | 详细信息 |
|
用符号“>”“<”或“=”连接下列各项关系。 (1)第一电离能:N___O,Mg___Ca。 (2)电负性:O___F,N__P。 (3)能量高低:ns__np,4s___3d。 |
|
| 22. 综合题 | 详细信息 |
|
(1)氯酸钾熔化时,微粒间克服了________;二氧化硅熔化时,微粒间克服了________;碘升华时,微粒间克服了________。三种晶体熔点由高到低的顺序是________________________________________________________________________。 (2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的熔点从低到高的顺序为________(填序号)。 (3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有________(填化学式,下同),由非极性键形成的非极性分子有________,能形成分子晶体的物质是________,晶体中含有氢键的是________,属于离子晶体的是________,属于原子晶体的是________,五种物质的熔点由高到低的顺序是____________。 |
|
最近更新



