江西省新余市第四中学2020届高三七月检测化学考题同步训练
| 1. 选择题 | 详细信息 |
|
中国科学技术大学的钱逸泰教授等以CCl4和金属钠为原料,在700oC时反应制造出纳米级金刚石粉末和另一种化合物。该成果发表在世界权威的《科学》杂志上,立即被科学家们高度评价为“稻草变黄金”。同学们对此有下列一些“理解”,你认为其中错误的是( ) A. 这个反应是氧化还原反应 B. 金刚石属于金属单质 C. 另一种化合物为NaCl D. 制造过程中元素种类没有改变 |
|
| 2. 选择题 | 详细信息 |
|
分类是学习化学的重要方法.下列归纳正确的是( ) A. SO2、SiO2、CO均为酸性氧化物 B. 纯碱、烧碱、熟石灰都属于碱类 C. 氨气、冰醋酸、食盐均为电解质 D. 碱性氧化物都是金属氧化物 |
|
| 3. 选择题 | 详细信息 |
|
我们常用“往伤口上撒盐”来比喻某些人乘人之危的行为,其实从化学的角度来说,“往伤口上撒盐”也有科学道理。那么,这种做法的化学原理是( ) A. 胶体的电泳 B. 血液的氧化还原反应 C. 血液中发生复分解反应 D. 胶体的聚沉 |
|
| 4. 选择题 | 详细信息 | |||||||||||||||
中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
|
||||||||||||||||
| 5. 选择题 | 详细信息 |
|
某同学想了解食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,用实验室标准NaOH溶液(浓度有0.100 0 mol/L和0.0100 mol/L两种)对其进行滴定。下列说法正确的是( ) A. 该实验应选用甲基橙作指示剂 B. 用0.100 0 mol/L标准NaOH溶液滴定时误差更小 C. 准确量取一定体积的白醋放人洗净的锥形瓶中后,可以再加少量蒸馏水后开始滴定 D. 滴定时,眼睛一直注视着刻度线,以防止液面下降到滴定管最大刻度以下 |
|
| 6. 选择题 | 详细信息 |
碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是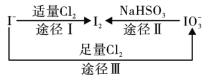 A. 氧化性的强弱顺序为:Cl2 >IO3- >I2 B. 一定条件下, I-与IO3-反应可能生成I2 C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3 D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色 |
|
| 7. 选择题 | 详细信息 |
|
在焊接铜器时可用NH4Cl溶液除去铜器表面的氧化铜以便焊接,其反应为:CuO+NH4Cl → Cu+CuCl2+N2↑+H2O(未配平)。下列说法正确的是 A. 反应中被氧化和被还原的元素分别为Cu和N B. 反应中氧化剂和还原剂的物质的量之比为3∶2 C. 反应中产生0.2 mol气体时,转移0.6 mol电子 D. 该反应中被还原的CuO占参与反应CuO的 |
|
| 8. 选择题 | 详细信息 | |||||||||||||||
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是()
|
||||||||||||||||
| 9. 选择题 | 详细信息 |
|
NA为阿伏加德罗常数的值。下列说法正确的是( ) A. 含4 mol HCl的浓盐酸与足量MnO2在加热条件下反应生成Cl2的分子数为NA B. 向1 L 0.1 mol·L-1氯化铵溶液中通入少量氨气调节溶液为中性,则NH4+的数目为0.1NA C. 向1 L 1 mol·L-1 FeBr2溶液中通入足量氯气,转移的电子数为3NA D. 密闭容器中1 mol N2与3 mol H2在一定条件下充分反应,生成的NH3分子数为2NA |
|
| 10. 选择题 | 详细信息 |
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )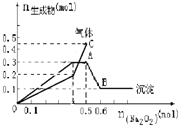 A. 1∶1∶2 B. 2∶2∶1 C. 1∶2∶2 D. 9∶2∶4 |
|
| 11. 选择题 | 详细信息 |
|
下列离子方程式错误的是 A. 金属钾与水反应:2K+2H2O=2K++2OH-+H2↑ B. 用醋酸溶解石灰石:CaCO3+2H+=Ca2++H2O+CO2↑ C. 氧化铝溶于NaOH溶液:Al2O3+2OH-=2AlO2-+H2O D. 向NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- |
|
| 12. 选择题 | 详细信息 | ||||||||||||||||||||
对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
|
|||||||||||||||||||||
| 13. 选择题 | 详细信息 |
|
下列各组物质相互混合反应,既有气体生成最终又有沉淀生成的是( ) ①金属钠投入MgCl2溶液中 ②过量的NaOH溶液和FeCl3溶液 ③碳酸氢铵加到过量的热的Ba(OH)2溶液中 ④过量的Na2O2投入FeCl2溶液中 ⑤过量NaOH和Ca(HCO3)2溶液混合 A. ①④ B. ②③ C. ①③④ D. ③④⑤ |
|
| 14. 选择题 | 详细信息 |
|
常温下,下列各组离子在指定溶液中能大量共存的是 A. B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32- C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO— D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl— |
|
| 15. 选择题 | 详细信息 |
|
将足量的CO2不断通入NaOH、Ca(OH)2、NaAlO2的混合溶液中,则生成沉淀的物质的量与通入CO2的体积的关系可表示为( ) A. 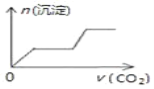 B. B.  C.  D. D.  |
|
| 16. 选择题 | 详细信息 |
某100mL溶液可能含有 Na+、NH4+、Fe3+、CO32-、SO42-、Cl-中的若干种,取该溶液进行连续实验,实验过程如图:(所加试剂均过量,气体全部逸出)下列说法正确的是 A. 若原溶液中不存在 Na+,则 c(Cl-)<0.1mol•L﹣1 B. 原溶液可能存在 Cl- 和 Na+ C. 原溶液中 c(CO32-)是 0.01mol•L﹣1 D. 原溶液一定存在 CO32-和SO42-,一定不存在 Fe3+ |
|
| 17. 综合题 | 详细信息 |
|
某化学兴趣小组要在“校园科艺节活动”中使用氢气球表演节目。经过测量,每个氢气球的体积约为1.12L(已折成标准状况)。 已知兴趣小组采用Al和氢氧化钠溶液反应制取氢气。 (1)若实验需要1L 2.5 mol·L-1的NaOH溶液,则要用称取NaOH固体______g。配制溶液过程中所需仪器除天平、钥匙、烧杯、玻璃棒外,还需要__________、____________(填仪器名称)。 (2)若要制取60个氢气球,至少需要Al的质量为_____g,转移的电子数为________。 (3)该化学兴趣小组为了营造气氛,做了惊艳全场的铝热反应(如下图),写出该反应的化学方程式____________________________。兴趣小组同学取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因可能是______。  (4)若要除去上述所得“铁块”中含有的氧化铝,可选择____(填试剂名称),所发生反应的化学方程式为________________。 |
|
| 18. 推断题 | 详细信息 |
某无色溶液100mL,其中可能含Fe3+、Al3+、Na+、Mg2+、Cu2+、NH4+、K+、CO32-、SO42-等离子中的几种,为分析其成分,取此溶液分别进行了四个实验,其操作和有关现象如下图所示。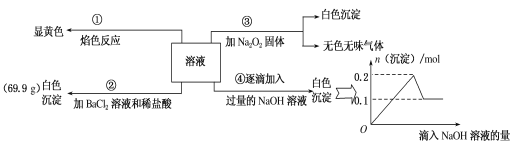 请回答下列问题: (1)焰色反应是_____(填“物理”或“化学”)变化;实验③中产生的无色无味气体是_____(填化学式)。 (2)原溶液中一定存在的离子有______________,可能存在的离子有_____________________,一定不存在的离子有______________(写化学式)。 (3)若溶液中K+物质的量为0.04 mol,则c(Na+)=________。 |
|
| 19. 综合题 | 详细信息 |
|
铝及其化合物在生活、生产中有广泛应用。 (1)Na3AlF6是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用HF、Na2CO3和Al(OH)3制备冰晶石。化学反应原理是,2Al(OH)3+3Na2CO3+12H=2Na3AlF6+3CO2↑+9H2O.属于盐的有Na2CO3和_______。上述反应不能在玻璃容器中反应,其原因是________(用化学方程式表示)。 (2)明矾[KAl(SO4)2·12H2O]常作净水剂。在明矾溶液中滴加氢氧化钡溶液至Al3+恰好完全沉淀,写出该反应的离子方程式____________。 (3)铝合金广泛用于建筑材料。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等(同温同压)。则该合金中铁、硅的质量之比为______。(已知:Si+2NaOH+H2O=Na2SiO3+ 2H2↑) (4)铝氢化钠(NaAlH4)是有机合成的重要还原剂。它的制备方法是将氢化钠和氯化铝在乙醚中反应制备铝氢化钠。 ①写出化学方程式________________。 ②在化学上,含氢还原剂的还原能力用“有效氢”表示,”有效氢”含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般地含氢还原剂的氢被氧化成H2O,“还原能力”用氢失去电子数多少表示。NaAlH4、NaH的“有效氢”之比为________。 |
|
| 20. 实验题 | 详细信息 |
用浓盐酸与氯酸钾固体反应制氯气时,发现所得气体颜色偏深,经分析该气体主要含有Cl2和ClO2两种气体,某研究性学习小组拟用如图所示装置分离制得的混合气体,并测定两种气体的物质的量之比。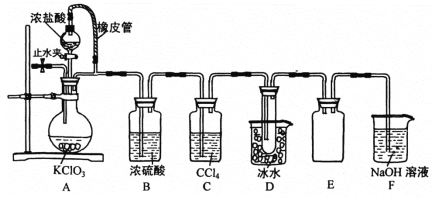 Ⅰ.查阅资料: 常温下二氧化氯为黄绿色气体,其熔点为-59.5℃,沸点为11.0℃,能溶于水,不溶于浓硫酸、四氯化碳,有强氧化性,能与NaOH溶液反应生成等物质的量的两种盐,其中一种为 NaClO3。 Ⅱ.制备与分离: (1)实验加药品前应进行的实验操作是____________。 (2)装置C、E的作用分别是 _________、_________。 (3)F中ClO2与NaOH 溶液反应的离子方程式为_____________。 Ⅲ.测量与计算: 反应结束后,测得B、C装置分别增重 2.0g和 14 .2g,将D中的液体溶于水,配成2.5 L溶液,取 25.00 mL该溶液,调节试样的pH﹤2.0 ,加入足量的 KI晶体,振荡后,静置片刻;加入指示剂X ,用 0.200mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25.00 mL 。(己知: 2ClO2+8H++10I-===5I2+2Cl-+4H2O;2Na2S2O3+I2===Na2S4O6 +2NaI ) (4)指示剂X为_____,滴定终点时的现象是_______________。 (5)原装置收集到的ClO2物质的量为___________。 Ⅳ.结论: (6)浓盐酸与氯酸钾固体反应的化学方程式为____________。 |
|
高中化学 试卷推荐
- 2018-2019年高一前半期第二学段考试化学题开卷有益(四川省遂宁市遂宁中学外国语实验学校)
- 2019届高三上学期第二次联考化学题带答案和解析(江西省新余市第四中学、上高县第二中学)
- 2018-2019年高一上半年期末考试化学考题同步训练(黑龙江省大庆实验中学)
- 2019-2020年高一上半期12月月考化学题开卷有益(云南省临沧市耿马县民族中学)
- 高二下半年期末考试化学题带参考答案(2019-2020年辽宁师范大学附属中学)
- 2018至2019年高一下半期5月月考化学考题(河南省洛阳市第一高级中学)
- 上海市2018年高一化学上学期期中考试完整试卷
- 巴彦淖尔市2018年高一化学上半年月考测验免费试卷
最近更新



