2019河北高一上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
磁铁矿的主要成分Fe3O4中铁元素的化合价显 A. +2价 B. +2和+3价 C. +
|
|
| 2. | 详细信息 |
|
《本草衍义》中有如下叙述:“嘉州峨眉山有燕萨石,形六棱而锐首,色莹白明澈。”这里“燕萨石”的主要成分可能是 A. SiO2 B. CaO C. NaCl D. C(石墨)
|
|
| 3. | 详细信息 |
|
合金是一类用途广泛的金属材料。下列物质中,不属于合金的是 A.水银 B.碳素钢 C.青铜 D.黄铜
|
|
| 4. | 详细信息 |
|
下列常见物质的俗名与化学式对应正确的是( ) A. 铁红—Fe3O4 B. 小苏打—Na2SO4 C. 石英—SiO2 D. 生石灰—Ca(OH)2
|
|
| 5. | 详细信息 |
|
光导纤维被认为是20世纪最伟大的发明之一,它使信息科学迅猛发展。光导纤维的主要成分是( ) A. CaCO3 B. SiO2 C. Na2SiO3 D. CaSiO3
|
|
| 6. | 详细信息 |
|
下列变化,通过一步反应不能实现的是( ) A.Na→Na2O2 B.SiO2→H2SiO3 C.Fe(OH)2→Fe(OH)3 D.Cu→CuCl2
|
|
| 7. | 详细信息 |
|
某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是
|
|
| 8. | 详细信息 | ||||||||||||
|
.硅是无极非金属材料的主角,下列物质含有硅单质的是( )
|
|||||||||||||
| 9. | 详细信息 |
|
下列有关Fe2(SO4)3溶液的叙述正确的是 A.该溶液中K+、Fe2+、SCN-、Br-可以大量共存 B.和H2S的离子方程式:2Fe3++H2S=FeS+ 2H+ C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH-=Fe(OH)3↓+BaSO4↓ D.1 L0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
|
|
| 10. | 详细信息 |
|
用FeCl3溶液腐蚀印刷电路板上的铜,所得溶液中加入铁粉。对加入铁粉充分反应后的溶液分析合理的是 A.若无固体剩余,则溶液中一定有Fe3+ B.若有固体存在,则溶液中一定有Fe2+ C.若溶液中有Cu2+,则一定没有固体析出 D.若溶液中有Fe2+,则一定有Cu析出
|
|
| 11. | 详细信息 |
|
用含少量镁粉的铝粉制取纯净的氢氧化铝,下述操作步骤中最恰当的组合是( ) ①加盐酸溶解 ②加足量烧碱溶液溶解 ③过滤 ④通入过量CO2生成Al(OH)3 沉淀 ⑤加入盐酸生成Al(OH)3沉淀 ⑥加入过量烧碱溶液 A.①⑥⑤③ B.②③④③ C.②③⑤③ D.①③⑤③
|
|
| 12. | 详细信息 |
|
在下列溶液中,若加入过量氨水或过量的氢氧化钠溶液,都产生沉淀,若加入铁粉,溶液能增重的是( ) A. FeCl3. B.FeCl2 C.AlCl3 D. MgCl2
|
|
| 13. | 详细信息 |
|
将10.2 g的镁和铝投入1000 ml 2 mol/L的盐酸中,金属完全溶解:再加入4 mol/L 的NaOH溶液,若要使生成的沉淀最多,则应加入NaOH溶液的体积是( )
|
|
| 14. | 详细信息 |
|
在含1 mol复盐NH4Al(SO4)2稀溶液中加入Ba(OH)2溶液,若生成l.6 mol BaSO4沉淀,则生成NH3·H2O的物质的量为( ) A. 0 mol B.0.2mol C.l mol D. 0.4mol
|
|
| 15. | 详细信息 |
|
证明某溶液中只含Fe2+而不含有Fe3+的实验方法是( ) A.先加氯水,再滴加KSCN溶液后显红色 B.先滴加KSCN溶液,不显红色,再滴加氯水后显血红色 C.滴加NaOH溶液,产生红褐色沉淀 D.只需要滴加KSCN溶液
|
|
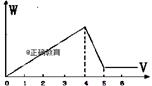
| 16. | 详细信息 |
|
Al2(SO4)3和MgSO4混和,加适量水溶解,再加入KOH溶液,析出的沉淀量(W)与KOH溶液体积(V)的关系如图,则Al2(SO4)3和MgSO4的物质的量之比是( ) A. 2:1 B. 1:2 C. 1:1 D. 1:3
|
|
| 17. | 详细信息 |
|
向一定量的Fe、FeO、Fe2O3的混合物中加入100 mL浓度为1.0 mol·L-1的盐酸,恰好使混合物完全溶解,有气体放出,所得溶液中加入KSCN溶液后无红色出现。若用足量的CO在高温下还原相同质量此混合物,能得到铁的质量是 ( ) A.11.2 B. 5.6 g C.2.8 g D.1.4 g
|
|
| 18. | 详细信息 |
|
有一铁的氧化物样品,用5mol/L盐酸140ml恰好完全溶解,所得溶液还能吸收标况下560ml氯气,Fe2+全部变成Fe3+,则该氧化物可能的化学式为 A. Fe2O3 B. Fe3O4 C.Fe4O5 D.Fe5O7
|
|
| 19. | 详细信息 |
|
盛放下列试剂的试剂瓶能用玻璃塞的是 A. 氢氧化钠溶液 B. 盐酸 C. 硅酸钠溶液 D. 碳酸钠溶液
|
|
| 20. | 详细信息 |
|
下列离子方程式中不正确的是 A.Na放入水中,产生气体:2Na + 2H2O = 2Na+ + 2OH- + H2↑ B.FeCl3溶液滴在淀粉碘化钾试纸上,试纸变蓝:2Fe3+ + 2I-= 2Fe2+ + I2 C.玻璃刻蚀:SiO2 +4H++4Cl- = SiCl4+2H2O D.Al片置于NaOH溶液中,产生气体:2Al + 2OH-+ 2H2O = 2AlO2- + 3H2↑
|
|
| 21. | 详细信息 |
|
如图所示物质的转化关系中,A是一种固体非金属单质,E是一种白色沉淀.请 回答下列问题:
(1)B的化学式是__________, 目前B已被用作______的主要原料. (2)B和a溶液反应的离子方程式是_________________________. (3)A和a溶液反应的离子方程式是__________________________. (4)G和过量的盐酸反应的离子方程式是________________________.
|
|
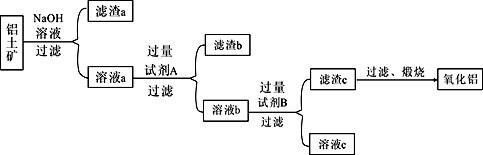
| 22. | 详细信息 |
|
工业上冶炼铝的原料是铝土矿( 主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:
(1)滤渣a中除含泥沙外,一定含有____。 (2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。 (3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。 (4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
|
|
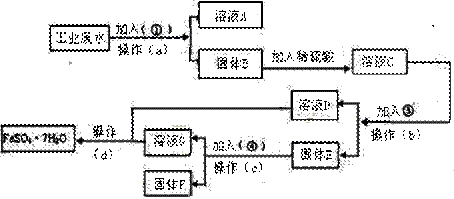
| 23. | 详细信息 |
|
某工厂的工业废水中含有大量的FeSO4,较多的CuSO4和少量Na2SO4。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据下列流程图,完成回收硫酸亚铁和铜的实验方案。
(1)加入的试剂①为______(填化学式),加入试剂①的目的是______。 (2)操作a的名称为过滤、洗涤,所需要的玻璃仪器为______。洗涤固体B的操作是_ _______。 (3)固体E的成分为_____,加入的试剂④为_ _,发生的化学方程式为__ ____。 (4)从溶液D和溶液G中得到FeSO4•7H2O晶体的操作为______、______、______、洗涤、干燥。
|
|