2018辽宁高一上学期人教版高中化学期末考试
| 1. | 详细信息 |
|
下列化学用语中正确的是 A.水合钠离子的示意图: B.NaHCO3的电离方程式:NaHCO3=Na++H++CO32- C.表示某原子的结构示意图: D.带结晶水的碳酸钠的可能化学式:Na2CO3·H2O
|
|
| 2. | 详细信息 |
|
下列与含氯化合物有关的说法正确的是 A.HClO是弱酸,所以NaClO是弱电解质 B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 C.六水合氯化钙可用作食品干燥剂 D.氯化铵、漂白粉都属于强电解质
|
|
| 3. | 详细信息 |
|
“分类”是一种思想,在化学发展中起到了重要作用。下列分类标准合理的是 A.根据分散系是否具有丁达尔效应将分散系分为溶液、胶体和浊液 B.根据分子中的氢原子数将酸分为一元酸、二元酸和多元酸 C.根据反应是否在溶液中进行将化学反应分为离子反应和非离子反应 D.根据在水溶液中或熔融状态下能否导电,将化合物分为电解质和非电解质
|
|
| 4. | 详细信息 |
|
化学与生产、生活息息相关,下列叙述错误的是 A.二氧化硫可广泛用于食品的增白 B.小苏打是面包发酵粉的主要成分之一 C.燃烧化石燃料是造成雾霾天气的一种重要因素 D.硅胶可用作食品干燥剂
|
|
| 5. | 详细信息 |
|
下列有关用途的叙述错误的是 A.常温下可用铁容器储运浓硫酸 B.焰色反应可用于检验某些金属元素的存在 C.氨是制造硝酸的原料 D.铝制餐具可以长时间盛放咸的食物
|
|
| 6. | 详细信息 |
|
下列各组物质: ①Cu与HNO3溶液 ②Cu与FeCl3溶液 ③Zn与H2SO4溶液 ④Fe与盐酸 ⑤ Na与O2。由于条件不同而能发生不同氧化还原反应的是 A.只有③④ B.只有①③⑤ C.只有①② D.只有①③④⑤
|
|
| 7. | 详细信息 |
|
下列表述正确的是 A.二氧化硅是将太阳能转化变为电能的常用材料 B.玻璃、水晶、玛瑙的主要成分都是硅酸盐 C.水玻璃可用于生产黏合剂和防火剂 D.二氧化硅既能跟HF 反应,又能跟NaOH 反应,因此二氧化硅是两性氧化物
|
|
| 8. | 详细信息 |
|
NA为阿伏加德罗常数,下列说法正确的是 A.1L1mol/L 的氨水中含有NH3分子数为NA B.将1mol FeCl3全部转化成胶体,其中氢氧化铁胶粒数为NA C.标准状况下,11.2LSO3所含的分子教为0.5NA D.Na2O2与H2O反应生成1.12LO2 (标准状况),反应中转移的电子数为0.1NA
|
|
| 9. | 详细信息 |
|
.能正确表示下列反应的化学方程式(或离子方程式) 的是 A.实验室制氨气:NH4++OH- B.硅酸钠溶液与醋酸溶液混合:SiO32- +2H+=H2SiO3↓ C.氢氧化亚铁的氧化:4Fe(OH)2+O2+2H2O=4Fe(OH)3↓ D.氯气与石灰乳反应:2Cl2+2Ca(OH)2=CaCl2+CaClO2+2H2O
|
|
| 10. | 详细信息 |
|
在给定条件下,下列加点的物质在化学反应中几乎能被完全消耗的是 A.大量NaClO溶液中通入少量CO2,密封,置于阳光下 B.向100mL18mol·L-1的浓硫酸中加入64g铜 C.标准状况下,将lg 铝片投入20mLl8mol·L-1的硫酸中 D.用50mL8mol·L-1 浓盐酸与10g 二氧化锰共热制取氯气
|
|
| 11. | 详细信息 |
|
能通过化合反应生成的物质是 ①Fe(OH)3 ②FeCl2 ③SO3 ④NH4Cl A.只有①② B.只有②③④ C.只有①②③ D.全部
|
|
| 12. | 详细信息 |
|
.下列反应的离子方程式正确的是 A.铁片溶于足量稀硝酸:Fe+4H++NO3-=Fe2++NO2↑+2H2O B.少量SO2通入漂 白 粉 溶液 中:Ca2++3ClO-+SO2+H2O=CaSO4↓+2HClO+Cl- C.钠与CuSO4溶液反应:2Na+Cu2+=Cu+2Na+ D.AlCl3溶液 与过量氨水反应:Al3++4OH-=AlO2-+2H2O
|
|
| 13. | 详细信息 |
|
下列叙述正确的是 A.CO、CO2、NO、NO2都是大气污染气体,在空气中都能稳定存在 B.焰色反应、离子反应中都一定存在化学反应 C.明矾溶于水能产生具有吸附性的胶体粒子,可作漂白剂 D.可用浓盐酸检验输送氨气的管道是否漏气
|
|
| 14. | 详细信息 |
|
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组是 A.(NH4)3PO4 NaCl Na2SO4 MgCl2 (KOH 溶液) B.BaCl2 FeSO4 (NH4)2SO4 AlCl3 (氨水) C.NH4HSO4 NH4Cl Na2CO3 MgCl2 (HNO3酸化的AgNO3溶液) D.NaOH KSCN NaCl AlCl3 (FeCl3溶液)
|
|
| 15. | 详细信息 |
|
下列离子一定能够大量共存的是 A.氢氧化铁胶体中:Na+、K+、S2-、Br- B.饱和FeCl3溶液:K+、NH4+、I-、Cl- C.含MnO4- 的溶液中:Fe2+、Mg2+、SO42-、NO3- D.与铝作用生成H2 的溶液中:Mg2+、K+、NO3-、Cl-
|
|
| 16. | 详细信息 |
|
下列实验现象描述正确的是 A.将足量SO2气体通入石蕊试液中,石蕊试液变红色 B.红热的铜丝在氯气中燃烧,产生了棕黄色的烟雾 C.碘水中加入少量汽油振荡,静置后上层颜色变浅,下层颜色变为紫红色 D.将过氧化钠加入足量的水中振荡,再滴入酚酞,震荡,溶液呈红色
|
|
| 17. | 详细信息 |
|
下列各图所示的实验原理、方法、装置和操作正确的是
A.①制备收集干燥的氨气 B.②干燥Cl2 C.③检验K2CO3中的K+ D.④从KI和I2的固体混合物中回收I2
|
|
| 18. | 详细信息 |
|
某溶液中可能合有Fe2+、Mg2+、Cu2+、NH4+、Al3+中的一种或几种。当加入一种淡黄色固体并加热时,有刺激性气体放出和白色沉定生成,加入淡黄色固体的物质的量(横坐标)与析出的沉淀和产生气体的物质的量(纵坐标) 的关系如图所示。下列叙述错误的是
A.溶液中一定含有的离子是NH4+、 Al3+和Mg2+ B.溶液中肯定不含有Cu2+,可能含有Fe2+ C.所加的淡黄色固体是Na2O2 D.溶液中的NH4+和Al3+的物质的量浓度之比3:1
|
|
| 19. | 详细信息 |
|
将152g铜镁合金完全溶解于50mL某浓度的硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),当向反应后的溶液中加入640mL 1.0mol/LNaOH溶液时,金属离于全部转化为沉淀,测得沉淀的质量为2.54g。下列说法正确的是 A.该合金中铜与镁的物质的量之比是1:2 B.该硝酸中HNO3的物质的量浓度是14.0mol/L C.NO2和N2O4的混合气体中,NO2的体积分数是20% D.该硝酸中HNO3的质量分数为60%
|
|
| 20. | 详细信息 |
|
久置空气中会发生颜色变化,但颜色变化是由于跟氧气反应引起的物质是 A.硫酸亚铁晶体 B.亚硫酸钠固体 C.过氧化钠固体 D.氯水
|
|
| 21. | 详细信息 |
|
Ⅰ.4.1gH3PO3可与2gNaOH 完全反应生成正盐,则H3PO3为 元酸。该正盐的电离方程式为 。 Ⅱ、小苏打、胃舒平、达喜都是常用的中和胃酸的药物。 (1)小苏打片每片含0.504gNaHCO3,2 片小苏打片能中和胃酸中的H+是_____mol。 (2) 胃舒平每片含0.234gAl(OH)3,中和胃酸时,6片小苏打片相当于胃舒平 。 (3) 达喜的化学成分是铝和镁的碱式碳酸盐。取该碱式盐粉末3.01g,逐滴加入2.0mol/L盐酸使其溶解(其他成分不与盐酸反应),当加入盐酸42.5mL 时,开始产生CO2,加入盐酸至45.0mL时怡好反应完全,则该碱式盐样品中氢氧根与碳酸根的物质的量之比为 。
|
|
| 22. | 详细信息 |
|
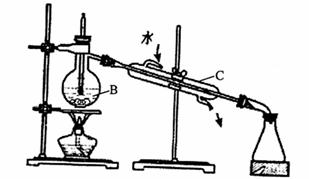
)综合利用海水可以制备淡水、食盐、纯碱、溴等物质,其流程如图所示:
(1)实验室中可用下图装置从海水中获得淡水,B、C仪器的名称分别是B 、 C ;B 装置中如果忘加沸石,应 ;下图装置中有 处错误。
(2)在母液中通入氯气可置换出单质溴,从溶液A 中提取Br2,需要的主要仪器 是 。 (3) 粗盐中含有Na2SO4、MgCl2、CaCl2等可溶性杂质,为制得纯净的NaCl晶体,操作如下: a、溶解; b、依次加入过量的 溶液、NaOH 溶液、C、 溶液; d、加适量盐酸; e、 (请补全缺少的试剂和实验步骤)。 (4) 实验室需要使用480mL0.1mol/L的该精制盐溶液,则配制该溶液时: ①需要用托盘天平称量氯化钠的质量 g ②下列实验操作会使配制结果偏高的是 A.砝码生锈了 B.定容时俯视刻度线 C.没洗涤烧杯和玻璃棒 D.容量瓶中残留少量蒸馏水 E.定容摇匀后,发现液面低于刻度线,又加少量蒸馏水至液面与刻度线相切 (5)向氯化钠溶液中先后通入的气体X、Y 的化学式分别为 、 ,你认为先通气体X 的原因是 ,该反应的化学方程式为 。 (6)用这种方法制得的Na2CO3中有少量的NaCl。检验该Na2CO3中少量的NaCl的实验操 作 为 。
|
|
| 23. | 详细信息 |
|
下图是无机物A~M 在一定条件下的转化关系(部分产物及反应条件来列出)。其中,I是由地壳中含量最多的金属元素组成的单质,k 是一种红棕色气体, C 是一种强酸。
请填写下列空白: (1) 写出下列物质的化学式:A: E: (2)写出反应④的离子方程式: 写出反应⑦的化学方程式: 写出反应⑩的化学方程式: (3)在反应②、③、⑥、⑧、⑨中,既属于化合反应又属于氧化还原反应的 。 (填写序号) (4) 写出检验M 溶液中阳离子的方法: (5)将化合物D 与KNO3、KOH 高温共融,可制得一种“绿色”环保高效净水剂K2FeO4 (高铁酸钾),同时还生成KNO2和H2O。写出该反应的化学方程式并用双线桥标出电子转移方向和数目: 。 (6)ClO2也是绿色净水剂,ClO2制备方法较多,我国科学家探索的新方法是: 氯气(Cl2)和固体亚氯酸钠(NaClO2) 反应,写出该反应的化学方程式: 。
|
|