2020甘肃高三上学期人教版(2019)高中化学月考试卷
| 1. | 详细信息 |
|
为除去括号内 A. Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 B. NaHCO3溶液(Na2CO3),应通入过量的CO2气体 C. Na2O2粉末(Na2O),将混合物在氧气中加热 D. Na2CO3溶液(Na2SO4),加入适量Ba(OH)2溶液,过滤
|
|
| 2. | 详细信息 |
|
下列说法正确的是( ) A. 向硫酸铝溶液中滴加碳酸钠溶液的离子方程式:2Al3++3CO32-=Al2(CO3)3↓ B. 泡沫灭火器灭火是利用了Al2(SO4)3和小苏打的反应 C. 铝与Fe2O3发生铝热反应,反应后固体物质增重 D. 氯化铝溶液滴入浓NaOH溶液中,产生大量白色沉淀
|
|
| 3. | 详细信息 |
|
有一块铁的“氧化物”样品,用140mL 5.0mol·L-1盐酸恰好将之完全溶解,所得溶液还能吸收0.025mol Cl2,恰好使其中的Fe2+全部转变为Fe3+,则该样品可能的化学式为 A Fe2O3 B. Fe3O4 C. Fe4O5 D. Fe5O7
|
|
| 4. | 详细信息 |
|
下列说法正确的是 A. 水泥、玻璃、青花瓷、水晶、玛瑙都属于硅酸盐工业产品 B. 二氧化碳通入水玻璃中可以得到原硅酸 C. 因为高温时二氧化硅与碳酸钠反应放出二氧化碳,所以硅酸酸性比碳酸强 D. 2MgO·SiO2中的酸根阴离子为SiO42-
|
|
| 5. | 详细信息 |
|
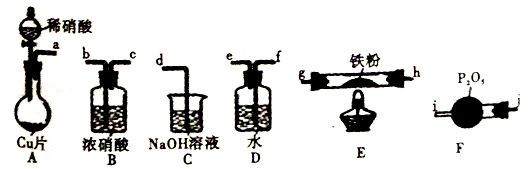
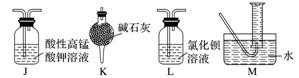
某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO),下列说法不正确的是
已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO A. 装置的连接顺序为a B. 装置E中发生的化学方程式为2NO+2Fe C. 装置D的作用是吸收挥发出来的硝酸和产生NO2 D. 装置B的作用是干燥,防止水蒸气进入E中干扰反应
|
|
| 6. | 详细信息 |
|
W、X、Y和Z为原子序数依次增大的四种短周期元素。W与X可生成一种红棕色有刺激性气味的气体;Y的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。下列叙述正确的是 A. X与其他三种元素均可形成两种或两种以上的二元化合物 B. Y与其他三种元素分别形成的化合物中只含有离子键 C. 四种元素的简单离子具有相同的电子层结构 D. W的氧化物对应的水化物均为强酸
|
|
| 7. | 详细信息 |
|
W、X、Y、Z均为短周期元素且原子序数依次增大,元素X和Z同族。盐YZW与浓盐酸反应,有黄绿色气体产生,此气体同冷烧碱溶液作用,可得到YZW的溶液。下列说法正确的是 A. 原子半径大小为W<X<Y<Z B. X的氢化物水溶液酸性强于Z的 C. Y2W2与ZW2均含有非极性共价键 D. 标准状况下W的单质状态与X的相同
|
|
| 8. | 详细信息 |
|
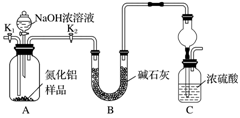
氮化铝(AlN)是一种新型无机非金属材料。为了分析某AlN样品(样品中的杂质不与氢氧化钠溶液反应)中AlN的含量,某实验小组设计了如下两种实验方案。 已知:AlN+NaOH+H2O=NaAlO2+NH3↑ 方案1 取一定量的样品,用以下装置测定样品中AlN的纯度(夹持装置已略去)。
(1)上图装置C中球形干燥管的作用是__________________________________________。 (2)完成以下实验步骤:组装好实验装置,首先____________,再加入实验药品。接下来的实验操作是____________,打开分液漏斗活塞,加入NaOH浓溶液,至不再产生气体。打开K1,通入氮气一段时间,测定装置C反应前后的质量变化。通入氮气的目的是___________。 (3)若去掉装置B,则导致测定结果________(填“偏高”“偏低”或“无影响”)。由于上述装置还存在缺陷,导致测定结果偏高,请提出改进意见:_______________________。 方案2 按以下步骤测定样品中AlN的纯度:
(4)步骤②生成沉淀的离子方程式为___________________________________________。 (5)步骤③的操作是_____________。
|
|
| 9. | 详细信息 |
|
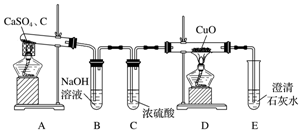
.CaS用于制备除虫剂、发光材料等。某课题组拟用硫酸钙和焦炭在高温下反应制备硫化钙并检验产物。 (1)甲同学设计如图所示实验装置检验气体产物。
B装置的作用是______________________________;D和E装置能检验装置A的反应产物中的________(填化学式);E装置中可能出现的现象是_________________________________。 (2)乙同学提出,根据氧化还原反应原理,装置A中的气体产物可能还有CO2、SO2,为了验证他的猜想,结合上述装置并选择下列仪器设计实验方案(同一种仪器可重复使用)。
①气流从左至右,仪器连接顺序为A、F、__________。 ②能证明有CO2的现象是______________________________________________________。 ③除去SO2的离子方程式为___________________________________________________。 (3)经实验检验气体产物有SO2、CO、CO2且气体体积之比为1∶1∶2,写出A中反应的化学方程式:________________________________________________________________________。
|
|
| 10. | 详细信息 |
|
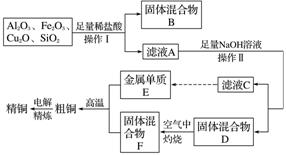
工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下(金属单质E可由滤液C制取):
已知:Cu2O+2H+===Cu+Cu2++H2O。 (1)实验操作Ⅰ的名称为________;在空气中灼烧固体混合物D时,用到多种硅酸盐质的仪器,除玻璃棒、酒精灯、泥三角外,还有________(填仪器名称)。 (2)滤液A中铁元素的可能存在形式为________(填离子符号),生成该离子的方程式为_____, 若滤液A中存在Fe3+,检验该离子的试剂为________(填试剂名称)。 (3)金属E和固体F反应发生的某一反应可用于焊接钢轨,该反应化学方程式为_________。
|
|
| 11. | 详细信息 |
|
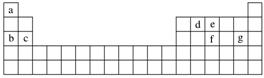
(1)现有下列10种物质:①O2;②H2;③NH4NO3;④Na2O2;⑤Ba(OH)2;⑥CH4;⑦CO2;⑧NaF;⑨NH3;⑩I2。其中既含离子键又含非极性键的是________(填序号,下同);既含离子键又含极性键的是________;。 (2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子。若XY2为常见元素形成的离子化合物,则其电子式为______________________________________________;若XY2为共价化合物,则其结构式为_________________________________________。 (3)氯化铝的物理性质非常特殊,如氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是______________(填“共价化合物”或“离子化合物”),可以证明该判断正确的实验依据是_______________________________________。 (4)现有a~g七种短周期元素,它们在元素周期表中的位置如图所示,请据此回答下列问题:
元素的原子间最容易形成离子键的是____(填字母,下同),容易形成共价键的是____。 A.c和f B.b和g C.d和g D.b和e
|
|