2019黑龙江高一下学期人教版(2019)高中化学期末考试
| 1. | 详细信息 |
|
下列有关元素的性质及其递变规律正确的是( ) A.IA族与ⅦA族元素间可形成共价化合物或离子化合物 B.第二周期元素从左到右,最高正价从+1递增到+7 C.同主族元素的简单阴离子还原性从上到下逐渐减弱。 D.同周期金属元素的化合价越高,其原子失电子能力越强
|
|
| 2. | 详细信息 |
|
短周期元素X、Y、Z、W、Q在元素周期表的位置如表所示,其中X元素的原子内层电子数是最外层电子数的一半,则下列说法正确的是( )
A.钠与W可能形成Na2W2化合物 B.由Z与Y组成的物质在熔融时能导电 C.W得电子能力比Q强 D.X有多种同素异形体,而Y不存在同素异形体
|
|
| 3. | 详细信息 |
|
下列说法正确的是( ) A.形成离子键的阴阳离子间只存在静电吸引力 B.HF、HCL、HBr、HI的热稳定性和还原性依次减弱 C.第三周期非金属元素含氧酸的酸性从左到右依次增强 D.元素周期律是元素原子核外电子排布周期性变化的结果
|
|
| 4. | 详细信息 |
|
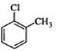
下列有关化学用语使用正确的是( ) A. 硫原子的原子结构示意图: B.NH4Cl的电子式: C.原子核内有10个中子的氧原子:18 8O D.对氯甲苯的结构简式:
|
|
| 5. | 详细信息 |
|
下列图示变化为吸热反应的是( )
|
|
| 6. | 详细信息 |
|
下列说法正确的是( ) A.密闭容器中充入1mol N2和3mol H2可生成2mol NH3 B.一定条件下,可逆反应达到平衡状态,该反应就达到了这一条件下的 最大限度 C.对于任何反应增大压强,化学反应速率均增大 D.化学平衡是一种动态平衡,条件改变,原平衡状态不会被破坏
|
|
| 7. | 详细信息 |
|
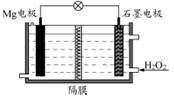
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是 A.Mg 电极是该电池的正极 B.H2O2 在石墨电极上发生氧化反应 C.石墨电极附近溶液的pH 增大 D.溶液中Cl-向正极移动
|
|
| 8. | 详细信息 |
|
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是( ) A.水既是氧化剂又是溶剂 B.放电时正极上有氢气生成 C.放电时OH-向正极移动 D.总反应为:2Li+2H2O
|
|
| 9. | 详细信息 |
|
下列关于常见有机物的说法不正确的是( ) A.乙酸和油脂都能与NaOH溶液反应 B.蛋白质、纤维素、蔗糖、油脂都是高分子化合物 C.淀粉水解与纤维素水解得到的最终产物相同 D.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
|
|
| 10. | 详细信息 |
|
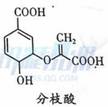
分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是
B. 可与乙醇、乙酸反应,且反应类型相同 C. 1mol分枝酸最多可与3mol D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
|
|
| 11. | 详细信息 |
|
某烃结构简式如下: A.18种 B.17种 C.16种 D.12种
|
|
| 12. | 详细信息 |
|
下列过程没有发生化学反应的是( ) A.用含硅胶、铁粉的透气小袋与食品一起密封包装 B.用热碱水清除炊具上残留的油污 C.用浸泡过高锰酸钾溶液的硅藻土保存水果 D.用活性炭去除冰箱中的异味
|
|
| 13. | 详细信息 |
|
下列反应中,属于取代反应的是( ) ①CH3CH=CH2+Br2 ②CH3CH2OH ③CH3COOH+CH3CH2OH ④C6H6+HNO3 A. ①② B. ③④ C. ①③ D. ②④
|
|
| 14. | 详细信息 |
|
分子式为C4H9Cl的同分异构体共有(不考虑立体异构)( ) A.2种 B.3种 C.4种 D.5种
|
|
| 15. | 详细信息 |
|
NaCl是海水中提取出来的一种重要物质,除食用外,它还是一种工业原料,下列以NaCl为原料的产品(或物质)是( ) ①烧碱 ②纯碱 ③金属钠 ④氯气 ⑤盐酸 A.①②③④⑤ B.①②③④ C.①②③⑤ D.①②④⑤
|
|
| 16. | 详细信息 |
|
以下实验能获得成功的是( ) A.用酸性KMnO4溶液鉴别乙烯和CH2===CH—CH3 B.将铁屑、溴水、苯混合制溴苯 C.苯和硝基苯采用分液的方法分离 D.将铜丝在酒精灯上加热后,立即伸入无水乙醇中,铜丝恢复成原来的红色
|
|
| 17. | 详细信息 |
|
下列说法错误的是( ) A.对废旧金属的最好处理方法是回收、再用 B.提炼金属要经过矿石的富集、冶炼、精炼三步 C.活泼金属的冶炼都是通过电解其盐溶液 D.热还原法中还原剂有焦炭、一氧化碳、氢气或活泼金属等
|
|
| 18. | 详细信息 | |||||||||||||||
|
下列由实验得出的结论正确的是( )
|
||||||||||||||||
| 19. | 详细信息 |
|
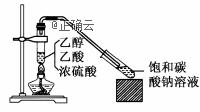
实验室采用如图所示装置制备乙酸乙酯,实验结束后,取下盛有饱和碳酸钠溶液的试管,再沿该试管内壁缓缓加入紫色石蕊试液1毫升,发现紫色石蕊试液存在于饱和碳酸钠溶液层与乙酸乙酯液层之间(整个过程不振荡试管),下列有关该实验的描述,正确的是( )
A.制备的乙酸乙酯中没有杂质 B.该实验中浓硫酸的作用是催化剂和脱水剂 C.石蕊层为三层环,由上而下是蓝、紫、红 D.饱和碳酸钠溶液主要作用是降低乙酸乙酯的溶解度及吸收乙醇、中和乙酸
|
|
| 20. | 详细信息 |
|
下列条件一定能使反应速率加快的是( ) ①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④加入生成物 ⑤加入MnO2 A.全部 B.①②⑤
|
|
| 21. | 详细信息 | ||||||||||||||
|
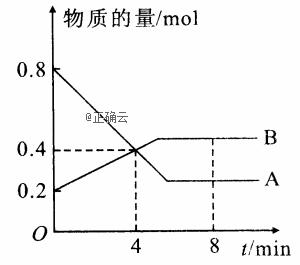
I.某温度时,在2L容器中A、B两种物质间的转化反应中A、B物质的量随时间变化的曲线如图所示,由图中数据分析得: (8分钟时A为0.2mol B为0.5mol)
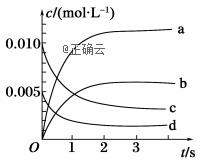
(1)该反应的化学方程式为_________________________。 (2)反应开始时至4min时,A的平均反应速率为________。 (3)4min时,反应是否达平衡状态?________(填“是”或“否”), 8min时,V正________V逆(填“>”“<”或“=”)。 II.在2L密闭容器中,800℃时反应2NO(g)+O2(g) →2NO2(g)体系中,n(NO)随时间的变化如表:
(1)上述反应________(填“是”或“不是”)可逆反应。 (2)如图所示,表示NO2变化曲线的是________。
(3)能说明该反应已达到平衡状态的是________(填序号)。 a.v(NO2)=2v(O2) b.容器内压强保持不变 c.v逆(NO)=2v正(O2) d.容器内密度保持不变
|
|||||||||||||||
| 22. | 详细信息 |
|
X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。 回答下列问题: ⑴ L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。 ⑵ Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的分子式为____________。 ⑶ 硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
|
|
| 23. | 详细信息 |
|
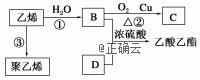
已知乙烯能发生以下转化:
(1)乙烯的结构式为:___________________________________。 (2)写出下列化合物官能团的名称: B中含官能团名称________________; D中含官能团名称________________。 (3)写出反应的化学方程式及反应类型: ①乙烯→B__________________;反应类型:________。 ②B→C__________________;反应类型:________。 ③B+D→乙酸乙酯_________________;反应类型:________。
|
|