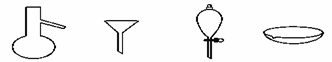2020еӣӣе·қй«ҳдёҖдёҠеӯҰжңҹдәәж•ҷзүҲ(2019)й«ҳдёӯеҢ–еӯҰжңҹжң«иҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еј•иө·зҺҜеўғжұЎжҹ“зҡ„еҺҹеӣ дёҚжӯЈзЎ®зҡ„жҳҜ A. йҮҚйҮ‘еұһгҖҒеҶңиҚҜе’ҢйҡҫеҲҶи§Јжңүжңәзү©гҖҒеҗ«NгҖҒPзҡ„жұЎж°ҙзӯүдјҡйҖ жҲҗж°ҙдҪ“жұЎжҹ“ B. иЈ…йҘ°жқҗж–ҷдёӯзҡ„з”ІйҶӣгҖҒиҠійҰҷзғғеҸҠж°ЎзӯүдјҡйҖ жҲҗеұ…е®ӨжұЎжҹ“ C. SO2гҖҒNO2е’ҢCO2йғҪдјҡеҜјиҮҙй…ёйӣЁзҡ„еҪўжҲҗ D. CO2зҡ„еӨ§йҮҸжҺ’ж”ҫдјҡйҖ жҲҗжё©е®Өж•Ҳеә”зҡ„еҠ еү§
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеӣҫжүҖзӨәжҳҜеҲҶзҰ»ж··еҗҲзү©ж—¶еёёз”Ёзҡ„д»ӘеҷЁпјҢд»Һе·ҰиҮіеҸіпјҢеҸҜд»ҘиҝӣиЎҢзҡ„ж··еҗҲзү©еҲҶзҰ»ж“ҚдҪңеҲҶеҲ«жҳҜ
A. и’ёйҰҸгҖҒи’ёеҸ‘гҖҒиҗғеҸ–гҖҒиҝҮж»ӨВ В В В В В В В В В В B. и’ёйҰҸгҖҒиҝҮж»ӨгҖҒиҗғеҸ–гҖҒи’ёеҸ‘ C. иҗғеҸ–гҖҒиҝҮж»ӨгҖҒи’ёйҰҸгҖҒи’ёеҸ‘В В В В В В В В В В В D. иҝҮж»ӨгҖҒи’ёеҸ‘гҖҒиҗғеҸ–гҖҒи’ёйҰҸ
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеұһдәҺзәҜеҮҖзү©зҡ„жҳҜ AгҖҒж¶Іж°ЁВ В В В В В В В В В В В BгҖҒжјӮзҷҪзІүВ В В В В В В В В В CгҖҒж°Ҝж°ҙВ В В В В В В В В В DгҖҒзӣҗй…ё
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҗ„з»„зү©иҙЁпјҢжҢүй…ёгҖҒзўұгҖҒзӣҗгҖҒйқһз”өи§ЈиҙЁзҡ„йЎәеәҸжҺ’еҲ—зҡ„жҳҜ A. зЎ«й…ёгҖҒиғҶзҹҫгҖҒж°ҜеҢ–й•ҒгҖҒдәҢж°§еҢ–зўіВ В В В В В В В В B. зЎқй…ёгҖҒзғ§зўұгҖҒе№ІеҶ°гҖҒиӢҸжү“ж°ҙ C. йҶӢй…ёгҖҒж¶ҲзҹізҒ°гҖҒжҳҺзҹҫгҖҒй“ңВ В В В В В В В В В В В В В D. ж°ҜеҢ–ж°ўгҖҒиӢӣжҖ§й’ гҖҒNaHCO3гҖҒж°Ёж°”
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
зЎ…еҸҠе…¶еҢ–еҗҲзү©еңЁжқҗж–ҷйўҶеҹҹдёӯеә”з”Ёе№ҝжіӣгҖӮдёӢеҲ—еҸҷиҝ°дёӯпјҢжӯЈзЎ®зҡ„жҳҜ A. жҷ¶дҪ“зЎ…жҳҜиүҜеҘҪзҡ„еҚҠеҜјдҪ“жқҗж–ҷВ В В В В В В В В B. зЎ…жҳҜең°еЈідёӯеҗ«йҮҸжңҖеӨҡзҡ„е…ғзҙ C. SiO2е’Ңй…ёпјҢзўұйғҪеҸҜд»ҘеҸҚеә”пјҢж•…дёәдёӨжҖ§ж°§еҢ–зү©В В В В В D. зЎ…жҳҜз”ҹдә§е…үеҜјзәӨз»ҙзҡ„дё»иҰҒеҺҹж–ҷ
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜ A. й’ еңЁж°§ж°”дёӯзҮғзғ§з”ҹжҲҗзҡ„ж·Ўй»„иүІзҡ„еӣәдҪ“Na2O2пјҢеҸҜеҒҡдёәе‘јеҗёйқўе…·зҡ„дҫӣж°§еүӮ B. е°Ҷи¶ійҮҸCO2ж°”дҪ“йҖҡе…ҘйҘұе’Ңзўій…ёй’ жә¶ж¶ІдёӯпјҢдјҡжһҗеҮәеӣәдҪ“ C. дҝқеӯҳзЎ«й…ёдәҡй“Ғжә¶ж¶Іж—¶еә”еҠ е…ҘдёҖе®ҡйҮҸзҡ„й“ҒзІү D. еҗ‘иҝҮж°§еҢ–й’ дёӯж»ҙе…Ҙзҙ«иүІзҹіи•ҠиҜ•ж¶ІпјҢжә¶ж¶Іе…ҲеҸҳзәўеҗҺиӨӘиүІ
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
е·ұзҹҘеңЁзўұжҖ§жә¶ж¶ІдёӯеҸҜеҸ‘з”ҹеҰӮдёӢеҸҚеә”пјҡ2R(OH)3+3C1OпјҚ+4OHпјҚ=2RO4nпјҚ+3ClпјҚ+5H2OгҖӮеҲҷ RO4nпјҚдёӯ R зҡ„еҢ–еҗҲд»·жҳҜ A. +7В В В В В В В В В В В B. +6В В В В В В В В C. +5В В В В В В В В В В В D. +4
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖјгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜ A. 5NH4NO3 B. е®Өжё©дёӢпјҢ0.2molВ·L-1зҡ„Na2SO4жә¶ж¶Ідёӯеҗ«Na+ж•°зӣ®дёә0.4NA C. ж ҮеҮҶзҠ¶еҶөдёӢпјҢNAдёӘHFеҲҶеӯҗжүҖеҚ зҡ„дҪ“з§ҜзәҰдёә22.4L D. й«ҳжё©дёӢпјҢ0.2molFeдёҺи¶ійҮҸж°ҙи’ёж°”еҸҚеә”пјҢз”ҹжҲҗзҡ„H2еҲҶеӯҗж•°зӣ®дёә0.3NA
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зҰ»еӯҗеңЁй…ёжҖ§жә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜ A. Fe3пјӢгҖҒNH4пјӢгҖҒSCNпјҚгҖҒClпјҚВ В В В В В В В В B. NaпјӢгҖҒMg2пјӢгҖҒNO C. Al3пјӢгҖҒFe2пјӢгҖҒNO
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
еҗёе…ҘдәәдҪ“е…§зҡ„ж°§жңү2%иҪ¬еҢ–дёәж°§еҢ–жҖ§жһҒејәзҡ„вҖңжҙ»жҖ§ж°§вҖқпјҢе®ғиғҪеҠ йҖҹдәәдҪ“иЎ°иҖҒпјҢиў«з§°дёәвҖңз”ҹе‘ҪжқҖжүӢвҖқпјҢжңҚз”Ёеҗ«зЎ’е…ғзҙ пјҲSeпјүзҡ„еҢ–еҗҲзү©дәҡзЎ’й…ёй’ пјҲNa2SeO3пјүпјҢиғҪж¶ҲйҷӨдәәдҪ“е…§зҡ„жҙ»жҖ§ж°§пјҢз”ұжӯӨжҺЁж–ӯNa2SeO3зҡ„дҪңз”ЁжҳҜ A. дҪңиҝҳеҺҹеүӮВ В В B. дҪңж°§еҢ–еүӮ C. ж—ўдҪңж°§еҢ–еүӮеҸҲдҪңиҝҳеҺҹеүӮВ В В D. ж—ўдёҚдҪңж°§еҢ–еүӮеҸҲдёҚдҪңиҝҳеҺҹеүӮ
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
е°ҶдёҖе®ҡйҮҸзҡ„Na2CO3дёҺNaHCO3зҡ„ж··еҗҲзү©е……еҲҶеҠ зғӯпјҢеҸҜ收йӣҶеҲ°ж ҮеҶөдёӢ A.
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжӯЈзЎ®зҡ„жҳҜ A. й“қзІүжҠ•е…ҘеҲ°NaOHжә¶ж¶Ідёӯпјҡ2Al + 2OH- = 2AlO2- + H2вҶ‘ B. е°ҸиӢҸжү“дёҺи¶ійҮҸжҫ„жё…зҹізҒ°ж°ҙеҸҚеә”пјҡ2HCO3- В + Ca2+ + 2OH- =CaCO3вҶ“ + CO32- + 2H2O C. AlCl3жә¶ж¶ІдёӯеҠ е…Ҙи¶ійҮҸзҡ„ж°Ёж°ҙпјҡAl3+ В + 4NH3В·H2OВ = AlO2- + 4NH4+ + 2H2O D. FeCl2жә¶ж¶ІдёӯеҠ е…Ҙж°Ҝж°ҙпјҡCl2 +2Fe2+ =2Fe3+ + 2Cl-
|
|
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
зӣҗй…ёе№ҝжіӣеә”з”ЁеңЁзЁҖжңүйҮ‘еұһзҡ„ж№ҝжі•еҶ¶йҮ‘гҖҒжјӮжҹ“е·ҘдёҡгҖҒйҮ‘еұһеҠ е·ҘгҖҒж— жңәиҚҜе“ҒеҸҠжңүжңәиҚҜзү©зҡ„з”ҹдә§зӯүйўҶеҹҹдёӯгҖӮHCl жһҒжҳ“жә¶дәҺж°ҙпјҢе·ҘдёҡдёҠз”Ё HCl ж°”дҪ“жә¶дәҺж°ҙзҡ„ж–№жі•еҲ¶еҸ–зӣҗй…ёгҖӮ пјҲ1пјүз”Ё 12.0mol/L жө“зӣҗй…ёй…ҚзҪ® 230mL 0.3mol/L зҡ„зЁҖзӣҗй…ёпјҢйңҖиҰҒйҮҸеҸ–жө“зӣҗй…ёзҡ„дҪ“з§Ҝдёә___mLпјӣ пјҲ2пјүжә¶ж¶ІзЁҖйҮҠиҝҮзЁӢдёӯйңҖиҰҒзҡ„зҺ»з’ғд»ӘеҷЁжңүзғ§жқҜгҖҒзҺ»з’ғжЈ’гҖҒйҮҸзӯ’гҖҒ____________гҖҒ___________пјӣ пјҲ3пјүжә¶ж¶ІзЁҖйҮҠиҝҮзЁӢдёӯжңүд»ҘдёӢж“ҚдҪңпјҡ aпјҺйҮҸеҸ–жө“зӣҗй…ёе’ҢдёҖе®ҡдҪ“з§Ҝзҡ„ж°ҙпјҢеңЁзғ§жқҜдёӯзЁҖйҮҠ bпјҺи®Ўз®—жүҖйңҖжө“зӣҗй…ёзҡ„дҪ“з§Ҝ cпјҺдёҠдёӢйў еҖ’ж‘ҮеҢҖ dпјҺеҠ и’ёйҰҸж°ҙиҮіеҲ»еәҰзәҝ 1-2cm ең°ж–№пјҢж”№з”Ёиғ¶еӨҙж»ҙз®ЎеҠ и’ёйҰҸж°ҙиҮіеҮ№ж¶ІйқўдёҺеҲ»еәҰзәҝзӣёеҲҮ eпјҺе°ҶзЁҖйҮҠж¶ІиҪ¬з§»е…Ҙе®№йҮҸ瓶пјҢжҙ—ж¶Өзғ§жқҜе’ҢзҺ»з’ғжЈ’пјҢ并е°Ҷжҙ—ж¶Өж¶ІиҪ¬з§»е…Ҙе®№йҮҸ瓶пјҢжҢҜиҚЎ д»ҘдёҠжӯЈзЎ®зҡ„ж“ҚдҪңйЎәеәҸдёә____________________________________________(еЎ«еәҸеҸ·)пјӣ пјҲ4пјүе®һйӘҢиҝҮзЁӢдёӯзҡ„д»ҘдёӢж“ҚдҪңдјҡеҜјиҮҙжңҖз»ҲжүҖй…Қжә¶ж¶Іжө“еәҰпјҲеЎ«вҖңеҒҸеӨ§вҖқгҖҒвҖңеҒҸе°ҸвҖқжҲ–вҖңдёҚеҸҳвҖқпјү aпјҺйҮҸеҸ–жө“зӣҗй…ёж—¶дҝҜи§Ҷпјҡ______________________пјӣ bпјҺйҮҸеҸ–жө“зӣҗй…ёеҗҺпјҢжё…жҙ—дәҶйҮҸзӯ’并е°Ҷжҙ—ж¶Өж¶ІиҪ¬з§»е…Ҙе®№йҮҸ瓶пјҡ______________________пјӣ cпјҺе®һйӘҢеүҚпјҢе®№йҮҸ瓶дёӯжңүе°‘йҮҸж®Ӣз•ҷи’ёйҰҸж°ҙпјҡ______________________пјӣ пјҲ5пјүж ҮеҮҶзҠ¶еҶөпјҢ1L ж°ҙдёӯйҖҡе…Ҙ aL HCl ж°”дҪ“пјҢеҝҪз•Ҙзӣҗй…ёжә¶ж¶Ідёӯ HCl зҡ„жҢҘеҸ‘пјҢеҫ—еҲ°зҡ„зӣҗй…ёжә¶ж¶ІеҜҶеәҰдёә b g/mLпјҢзү©иҙЁзҡ„йҮҸжө“еәҰдёә ______________________mol/LгҖӮ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
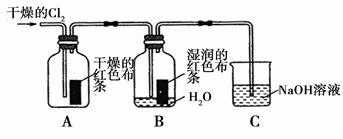
ж°Ҝж°”жҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·ҘеҺҹж–ҷпјҢеңЁе·ҘеҶңдёҡз”ҹдә§гҖҒз”ҹжҙ»дёӯжңүзқҖйҮҚиҰҒзҡ„еә”з”ЁгҖӮжҹҗеҢ–еӯҰе…ҙи¶Је°Ҹз»„еҗҢеӯҰеҜ№ж°Ҝж°”зҡ„жҖ§иҙЁиҝӣиЎҢеҰӮдёӢжҺўз©¶пјҡ пјҲ1пјүе…ҙи¶Је°Ҹз»„еҗҢеӯҰжҢүдёӢеӣҫиЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҢжҺўз©¶Cl2зҡ„жјӮзҷҪжҖ§гҖӮ
в‘ йҖҡе…ҘCl2 еҗҺпјҢи§ӮеҜҹеҲ°зҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В ж №жҚ®зҺ°иұЎеҸҜеҫ—еҮәзҡ„з»“и®әжҳҜВ В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎйӣҶ气瓶BеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В гҖӮ в‘ўCиЈ…зҪ®зҡ„дҪңз”ЁжҳҜВ В В В В В В В В В В В В В В В В В В В В пјҢиӢҘжңү2.24L(ж ҮеҮҶзҠ¶еҶөдёӢ)Cl2иў«NaOHжә¶ж¶Іе®Ңе…Ёеҗёж”¶пјҢеҲҷеҸҚеә”иҝҮзЁӢдёӯиҪ¬з§»зҡ„з”өеӯҗдёә В В В В В В В В В В В В В В В В В В В В В В В В В В В molгҖӮ пјҲ2пјүе…ҙи¶Је°Ҹз»„еҗҢеӯҰжҢүдёӢеӣҫиЈ…зҪ®иҝӣиЎҢе®һйӘҢпјҢжҺўз©¶Cl2зҡ„ж°§еҢ–жҖ§гҖӮ
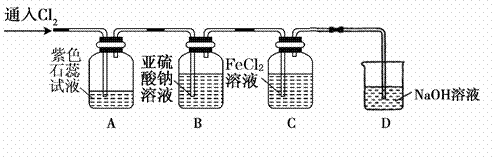
в‘ е®һйӘҢејҖе§ӢеҗҺпјҢи§ӮеҜҹиЈ…зҪ®A дёӯзҡ„зҺ°иұЎжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ЎиЈ…зҪ®CдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ в‘ўеҒңжӯўйҖҡе…Ҙж°Ҝж°”пјҢеҸ–иЈ…зҪ®Bдёӯе°‘йҮҸжә¶ж¶ІдәҺжҙҒеҮҖзҡ„иҜ•з®ЎдёӯпјҢеҗ‘е…¶дёӯж»ҙеҠ и¶ійҮҸзЁҖзӣҗй…ёпјҢеҶҚеҗ‘е…¶дёӯж»ҙеҠ ж°ҜеҢ–й’Ўжә¶ж¶ІпјҢжңүзҷҪиүІжІүж·Җз”ҹжҲҗгҖӮеҲҷйҖҡе…ҘCl2ж—¶иЈ…зҪ®BдёӯеҸ‘з”ҹеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗжә¶ж¶ІеҸӘеҸҜиғҪеҗ«жңүKпјӢгҖҒAl3пјӢгҖҒFe3пјӢгҖҒMg2пјӢгҖҒBa2пјӢгҖҒNH4+гҖҒClпјҚгҖҒCO32-гҖҒSO42-дёӯзҡ„иӢҘе№Із§ҚзҰ»еӯҗгҖӮжҹҗеҗҢеӯҰеҸ–100 mLзҡ„жә¶ж¶ІеҲҶжҲҗдёӨзӯүд»ҪиҝӣиЎҢеҰӮдёӢе®һйӘҢпјҡ ①第дёҖд»ҪеҠ иҝҮйҮҸзҡ„ж°ўж°§еҢ–й’ жә¶ж¶ІеҗҺеҠ зғӯпјҢ收йӣҶеҲ°0.05 molжңүеҲәжҝҖжҖ§ж°”е‘ізҡ„ж°”дҪ“пјҢеҗҢж—¶еҫ—еҲ°жҫ„жё…жә¶ж¶Із”ІгҖӮ в‘Ўеҗ‘жә¶ж¶Із”ІдёӯйҖҡе…ҘиҝҮйҮҸзҡ„дәҢж°§еҢ–зўіж°”дҪ“пјҢз”ҹжҲҗзҷҪиүІжІүж·ҖпјҢжІүж·Җз»ҸиҝҮж»ӨпјҢжҙ—ж¶ӨзҒјзғ§еҗҺпјҢеҫ—еҲ°1.02 gеӣәдҪ“гҖӮ ③第дәҢд»ҪеҠ и¶ійҮҸзҡ„ж°ҜеҢ–й’Ўжә¶ж¶ІеҗҺпјҢз”ҹжҲҗзҷҪиүІжІүж·ҖпјҢеҠ е…Ҙи¶ійҮҸзӣҗй…ёпјҢжІүж·Җ并дёҚжә¶и§ЈпјҢиҝҮж»ӨжІүж·ҖпјҢе……еҲҶжҙ—ж¶ӨпјҢе№ІзҮҘпјҢеҫ—еҲ°11.65 gеӣәдҪ“гҖӮ пјҲ1пјүеңЁеҺҹжә¶ж¶ІдёӯдёҖе®ҡеӯҳеңЁзҡ„зҰ»еӯҗжңү_________________________________пјӣдёҖе®ҡдёҚеӯҳеңЁзҡ„зҰ»еӯҗжңү_____________________пјӣдёҚиғҪзЎ®е®ҡжҳҜеҗҰеӯҳеңЁзҡ„зҰ»еӯҗжңү___________гҖӮ пјҲ2пјүдёәдәҶзЎ®е®ҡдёҚиғҪзЎ®е®ҡзҡ„зҰ»еӯҗжҳҜеҗҰеӯҳеңЁпјҢеҸҜд»ҘйҮҮеҸ–зҡ„ж–№жі•дёә__________________________________гҖӮ пјҲ3пјүз”ұж“ҚдҪңв‘ЎзЎ®е®ҡзҡ„зҰ»еӯҗеңЁжә¶ж¶Ідёӯзҡ„жө“еәҰдёә___________гҖӮ
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
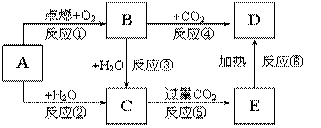
дёӢиҫ№еӣҫзӨәдёӯпјҢAдёәдёҖз§Қеёёи§Ғзҡ„еҚ•иҙЁпјҢBгҖҒCгҖҒD гҖҒEжҳҜеҗ«жңүAе…ғзҙ зҡ„еёёи§ҒеҢ–еҗҲзү©гҖӮе®ғ们зҡ„з„°иүІеҸҚеә”еқҮдёәй»„иүІгҖӮ В пјҲ1пјүеҶҷеҮәдёӢеҲ—зү©иҙЁзҡ„еҢ–еӯҰејҸпјҡ B___________В В В В В В В В В E___________ пјҲ2пјүд»ҘдёҠеҸҚеә”дёӯеұһдәҺж°§еҢ–иҝҳеҺҹеҸҚеә”зҡ„жңү__________________пјҲеЎ«еҶҷзј–еҸ·пјү пјҲ3пјүеҶҷеҮәBвҶ’CеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ并用еҚ•зәҝжЎҘж ҮеҮәз”өеӯҗиҪ¬з§»ж–№еҗ‘е’Ңж•°зӣ® _______________ EвҶ’Dзҡ„еҢ–еӯҰж–№зЁӢејҸ ________________________________________________ пјҲ4пјүеҠ зғӯ5.00g Dе’ҢEзҡ„еӣәдҪ“ж··еҗҲзү©пјҢдҪҝEе®Ңе…ЁеҲҶи§ЈпјҢеӣәдҪ“ж··еҗҲзү©зҡ„иҙЁйҮҸеҮҸе°‘дәҶ0. 31gпјҢеҲҷеҺҹж··еҗҲзү©дёӯDзҡ„иҙЁйҮҸдёә_________гҖӮ
|
|
- 2019еұҠй«ҳдёүдёҠеҚҠе№ҙжңҹжң«иҖғиҜ•еҢ–еӯҰпјҲиҫҪе®ҒзңҒеҮҢжәҗеёӮ第дәҢй«ҳзә§дёӯеӯҰпјү
- 2018-2019е№ҙй«ҳдёҖдёӢеҚҠе№ҙ第дёҖж¬ЎиҒ”иҖғеҢ–еӯҰиҜ•еҚ·пјҲиҫҪе®ҒзңҒеҮҢжәҗеёӮпјү
- 2019-2020е№ҙй«ҳдёҖдёҠеӯҰжңҹ第дёүеӯҰж®өиҙЁйҮҸжЈҖжөӢеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§ЈжһҗпјҲеұұдёңзңҒжөҺе®ҒеёӮеҫ®еұұеҺҝ第дәҢдёӯеӯҰпјү
- зӨәиҢғдёӯеӯҰй«ҳдәҢеҢ–еӯҰејҖеӯҰиҖғиҜ•пјҲ2019е№ҙдёҠжңҹпјүе…Қиҙ№жЈҖжөӢиҜ•еҚ·
- 2019-2020е№ҙй«ҳдәҢдёҠеҚҠе№ҙжңҹдёӯиҖғиҜ•еҢ–еӯҰиҜ•еҚ·пјҲиҫҪе®ҒзңҒиҫҪ河油田第дәҢй«ҳзә§дёӯеӯҰпјү
- иҘҝе®үеёӮ2018е№ҙй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹдёӯиҖғиҜ•еңЁзәҝзӯ”йўҳ
- 2018-2019е№ҙй«ҳдёҖдёӢеӯҰжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲпјҲжұҹиҘҝзңҒе®ңдё°дёӯеӯҰпјү
- ж–°з–Ҷ2019е№ҙй«ҳдәҢеҢ–еӯҰдёӢеӯҰжңҹжңҹдёӯиҖғиҜ•е…Қиҙ№иҜ•еҚ·