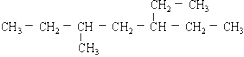2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
在密闭容器里,A与B反应生成C,其反应速率分别用vA、vB、vC表示,已知2vB=3vA、3vC=2vB,则此反应可表示为( ) A. 2A+3B=2C B. A+3B=2C C. 3A+B=2C D. A+B=C
|
|
| 2. | 详细信息 |
|
下列用水就能鉴别的一组物质是( ) A. 苯、己烷、四氯化碳 B. 苯、乙醇、四氯化碳 C. 硝基苯、乙醇、四氯化碳 D. 硝基苯、乙醇、乙酸
|
|
| 3. | 详细信息 | ||||||||||
|
某混合溶液中所含离子的浓度如下表,则M离子可能为( )
A. Cl- B. Ba2+ C. Na+ D. Mg2+
|
|||||||||||
| 4. | 详细信息 |
|
已知甲苯的一氯代物有4种同分异构体,将甲苯完全氢化后,再发生氯代反应,其一氯代物的同分异构体数目有( ) A. 4种 B. 5种 C. 6种 D. 7种
|
|
| 5. | 详细信息 |
|
4P(红磷s) A. 正反应是一个放热反应 B. 当l mol白磷完全转变成红磷时放出17kJ热量 C. 当4g红磷转变成白磷时吸收17kJ热量 D. 白磷比红磷稳定
|
|
| 6. | 详细信息 |
|
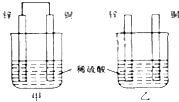
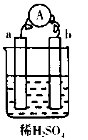
将纯锌片和纯铜片按如图方式插入同浓度的稀硫酸中一段时间,下列叙述正确的是
A. 两烧杯中铜片表面均无气泡产生 B. 甲中铜片是正极,乙中铜片是负极 C. 两烧杯中溶液的pH均增大 D. 甲、乙溶液均变蓝色
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是 ( ) A. Na2CO3溶液中通入少量CO2:CO32-+CO2+H2O B. 氯气通入亚硫酸钠溶液中:2Cl2 + SO32- + H2O C. 氯化铁溶液与碘化氢溶液反应:2Fe3+ +2HI D. FeBr2溶液中通入过量Cl2:2Fe2+ + 2Br- +2Cl2
|
|
| 8. | 详细信息 |
|
下列结论正确的是 ( ) ①原子半径:K>Cl>S ②氢化物稳定性:HF>H2S>PH3 ③离子还原性:S2->Cl->Br->I- ④单质氧化性:Cl2>S>Si ⑤酸性:H2SO4>HClO ⑥碱性强弱:KOH>NaOH>Mg(OH)2 A. ①④⑤ B. ③⑥ C. ②④⑤⑥ D. ①③④
|
|
| 9. | 详细信息 |
|
在原电池构成的闭合回路中,关于电子和阴、阳离子运动方向的描述正确的是( ) A. 电子从原电池的负极通过导线移向正极 B. 电子从原电池的正极通过导线移向负极 C. 阴离子在电解质溶液中向正极移动 D. 阳离子在电解质溶液中向负极移动
|
|
| 10. | 详细信息 |
|
被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰。在纸内的离子“流过”水和氧化锌组成的电解液。电池总反应为: Zn +2 MnO2+H2O = ZnO +2MnO(OH) ,下列说法正确的是( ) A. 该电池的正极为锌 B. 该电池反应中二氧化锰起催化剂作用 C. 当 0.lmol Zn 完全溶解时,流经电解液的电子个数为 1.204×l023 D. 电池正极反应式为:2MnO2 + 2e一+ 2H2O = 2MnO+2OH-
|
|
| 11. | 详细信息 |
|
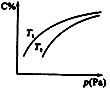
在密闭容器中,对于可逆反应A+3B
A. 若正反应方向ΔH<0,则T 1 >T 2 B. 压强增大时,混合气体的平均相对分子质量减小 C. B一定为气体 D. A一定为气体
|
|
| 12. | 详细信息 |
|
在298K、100kPa时,已知: 2H2O(g) = 2H2(g) + O2(g) ΔH1; Cl2(g) + H2(g) = 2HCl(g) ΔH2; 2Cl2(g) + 2H2O(g) = 4HCl(g) + O2(g) ΔH3; 则ΔH3与ΔH1和ΔH2间的关系正确的是( ) A. ΔH3=ΔH1+2ΔH2 B. ΔH3=ΔH1+ΔH2 C. ΔH3=ΔH1-2ΔH2 D. ΔH3=ΔH1-ΔH2
|
|
| 13. | 详细信息 |
|
a.b.c.d为短周期元素,a的M电子层有1个电子,b的最外层电子数为内层电子数的2倍,c的最高化合价为最低化合价绝对值的3倍,c与d同周期,d的原子半径小于c。下列叙述错误的是 A. d元素的非金属性最强 B. 它们均存在两种或两种以上的氧化物 C. 只有a与其他元素形成的化合物都是离子化合物 D. b.c.d与氢形成的化合物中化学键均为极性共价键
|
|
| 14. | 详细信息 |
|
. 下列有关化学研究的正确说法是 A. 同时改变两个变量来研究反映速率的变化,能更快得出有关规律 B. 对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同 C. 依据丁达尔现象可将分散系分为溶液、胶体与浊液 D. 从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属递增的规律
|
|
| 15. | 详细信息 |
|
运用相关化学知识进行判断,下列结论正确的是 A. 某吸热反应能自发进行,因此该反应是熵增反应 B. 加压改变反应速率的原因是加压可以改变活化分子的百分数 C. 对应某一可逆反应外界条件发生变化,只要平衡发生移动平衡常数一定变化 D. 增大反应物浓度可加快反应速率,因此用浓硫酸与铁反应能增大生成H2的速率
|
|
| 16. | 详细信息 |
|
过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2 A. 增大压强可加快该反应速率 B. 加入合适的催化剂可改变该反应的反应热 C. 达到平衡时,用任意组分表示正逆反应速率都有v(正)=v(逆) D. 达到平衡时,H2O2转化率为100%
|
|
| 17. | 详细信息 |
|
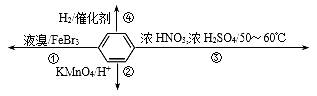
下列关于苯(下图所示)的叙述正确的是( )
A. 反应②不发生,但是仍有分层现象,紫色层在下层 B. 反应①常温下能进行,其有机产物为 C. 反应③为加成反应,产物是三硝基甲苯 D. 反应④中1mol苯最多与3 mol H2发生加成反应,是因为苯分子含有三个碳碳双键
|
|
| 18. | 详细信息 |
|
含有一个双键的烯烃,和氢加成后的产物结构简式如图,则此烯烃可能的结构有( )
A. 7种 B. 6种 C. 5种 D. 4种
|
|
| 19. | 详细信息 |
|
下列物质中,既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( ) ①SO2、②CH3CH2CH===CH2、③ A. ①② B. ③④ C. ①②④ D. ①②③④
|
|
| 20. | 详细信息 |
|
从化学键的角度看化学反应的实质是“旧化学键的断裂,新化学键的形成”下列既有旧化学键的断裂,又有新化学键的形成的变化( ) A. 酒精溶于水 B. 水冻成冰 C. 氯化钠受热熔化 D. 氧化钙作为干燥剂吸水
|
|
| 21. | 详细信息 |
|
在10 L密闭容器中,1 mol A和3 mol B在一定条件下反应:A(g)+xB(g) =2C(g),2 min后反应达到平衡时,测得混合气体共3.4 mol,生成0.4 mol C,则下列计算结果正确的是 A. 平衡时,物质的量之比n(A)∶n(B)∶n(C)=2∶11∶4 B. x值等于3 C. A的转化率为20% D. B的平均反应速率为0.4 mol·L-1·min-1
|
|
| 22. | 详细信息 |
|
下列表示物质结构的化学用语或模型正确的是 A. 二氧化碳的结构式: O=C=O B. HF的电子式: C. Cl-离子的结构示意图:
|
|
| 23. | 详细信息 |
|
在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述正确的是
A. 碳棒上有气体放出,溶液酸性变弱 B. a是正极,b是负极 C. 导线中有电子流动,电流从a极到b极 D. a极上发生了还原反应
|
|
| 24. | 详细信息 | ||||||||||||||||||||
|
下列实验中操作及现象与结论对应关系不正确的一组是
A. A B. B C. C D. D
|
|||||||||||||||||||||
| 25. | 详细信息 |
|
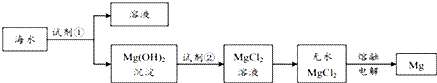
目前世界上60%的镁是从海水中提取的.主要步骤如下:
下列说法不正确的是 A. 为使海水中的MgSO4转化成Mg(OH)2,试剂①可选择石灰乳 B. 加入试剂①后,分离得到Mg(OH)2沉淀的方法是过滤 C. 加入试剂②反应的离子方程式为:OH﹣+H+=H2O D. 通过电解熔融的无水MgCl2得到48gMg,共转移4mol电子
|
|
| 26. | 详细信息 |
|
某烃A含碳85.7%,则该烃的最简式为________________;经测定其相对分子质量为42,则该烃的分子式为__________________; 有机物在一定条件下可以相互转化: A 写出下列转化过程的化学方程式: A B B A发生加聚反应____________________________________。
|
|
| 27. | 详细信息 |
|
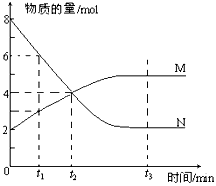
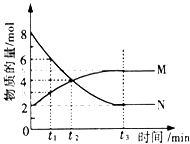
一定温度下,某容积为2L的密闭容器内,某一反应中M、N的物质的量随反应时间变化的曲线如下图,依图所示:
(1)该反应的化学方程式是_____________________。 (2)在图上所示的三个时刻中,_____(填t1、t2或t3)时刻处于平衡状态,此时V正____V逆(填>、<或=,);达到平衡状态后,平均反应速率v(N)﹕v(M)= _____。 (3)若反应容器的容积不变,则“压强不再改变”_______(填“能”或“不能”)作为该反应已达到平衡状态的判断依据。 (4)已知M、N均为气体,则下列措施能增大反应速率的是_____(选填字母)。 A.升高温度 B.降低压强 C.减小M的浓度 D.将反应容器体积缩小
|
|
| 28. | 详细信息 |
|
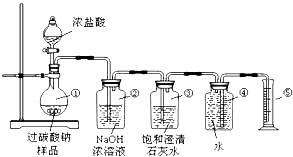
过碳酸钠(Na2CO4)在洗涤、印染、纺织、造纸、医药卫生等领域有大量应用,某化学研究性学习小组设计并完成了如下实验.测定过碳酸钠样品(含有的杂质不溶于水且不与酸反应)的纯度. 实验原理:2Na2CO4+4HCl═4NaCl+2CO2↑+O2↑+2H2O 实验装置:
交流与讨论: Ⅰ.甲同学认为测定产物中O2的体积即可测定样品的纯度. (1)装置②的作用是_________________。 (2)装置③的作用是:__________________。 (3)称取适量样品与足量浓盐酸充分反应后,收集到的氧气的体积为0.25L(已知该实验条件下氧气的密度为1.28g/L),则称取的样品质量应大于_______________g。 Ⅱ.乙同学认为测定产物中CO2的质量(即反应前后装置②的质量差)就可测定样品的纯度.但利用上述实验装置测得CO2的质量并计算样品的纯度,结果会偏高,你认为原因可能是_________________;(填序号) A.浓盐酸易挥发,产生的氯化氢气体被装置②吸收 B.二氧化碳气体逸出时带出的水蒸气在装置②中冷凝而被吸收 C.装置①、②内空气中的二氧化碳被装置②吸收 Ⅲ.丙同学提出了一种新方案,得到了大家的一致认可:称取样品12.5g,滴加足量浓盐酸至样品反应完全,再将烧瓶中所有的液体蒸发、结晶、烘干,称得氯化钠固体11.7g.则该样品的纯度为_______________。
|
|
| 29. | 详细信息 |
|
(1)已知下列两个热化学方程式: 2H2(g)+O2(g) = 2H2O(l) ΔH=-571.6 kJ•mol-1 C3H8(g)+5O2(g) = 3CO2(g)+4H2O(l) ΔH=-2220 kJ•mol-1 则H2的燃烧热为_______________________,1 mol H2和2 mol C3H8组成的混合气体完全燃烧释放的热量为______________。 (2)一定温度下,在4L密闭容器内某一反应中气体M,气体N的物质的量随时间变化的曲线如图所示:
① 若t2=2min,计算反应开始至t2时刻,M的平均化学反应速率为:__________________; ② t3时刻化学反应达到平衡时反应物的转化率为____________; ③ 如果升高温度则v逆 ________(填增大、减小或不变).
|
|
| 30. | 详细信息 |
|
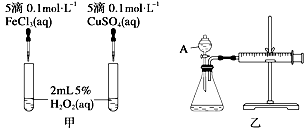
经研究知Cu2+对H2O2分解也具有催化作用,为比较Fe3+和Cu2+对H2O2分解的催化效果,某研究小组的同学分别设计了如图甲、乙所示的实验。回答相关问题: (1)定性分析: ①如图甲可通过观察____________________________,定性比较得出结论。 ②有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是______________________。 ③若H2O2在二氧化锰催化作用下发生反应,曾检测出有物质MnO3出现,写出整个反应过程的两个化学方程式:_______________,________________________。 (2)定量分析:如图乙所示,实验时均以生成40 mL气体为准,其他可能影响实验的因素均已忽略。图中仪器A的名称为________,实验中需要测量的数据是_________________。
|
|