2018福建高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
可爱的科学家规定了氢化物的定义,氢化物属于化合物,其中一种元素是氢元素,下列物质不属于氢化物的是( ) A、HCl B、NaH C、H2SO4 D、CH4
|
|
| 2. | 详细信息 |
|
我们高大上的阿伏加德罗常数的值设为NA,下列说法正确的是( ) A. 1 mol Na2O2固体中含离子总数为4NA B.100 mL 1.0 mol·L-1 FeCl3溶液与足量Cu反应,转移的电子数为0.2NA C.标准状况下,11.2 L CCl4中含有C—Cl键的数目为2NA D. 常温常压下,92 g NO2和N2O4的混合气体中含有的原子总数为6NA
|
|
| 3. | 详细信息 |
|
清晨的第一缕阳光将你从梦中吵醒,让你睁开朦胧的睡眼,给了你一个明亮的世界,这时候你想到,空气是胶体,那么,溶液、胶体和浊液这三种分散系的本质区别是( ) A.是否有丁达尔现象 B.是否能透过滤纸 C.分散质粒子的大小 D.是否均一、透明、稳定
|
|
| 4. | 详细信息 |
|
五颜六色的颜色变化增添了化学的魅力,下列有关反应的颜色叙述正确的是( ) ①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇单质碘→蓝色 ③溴化银见光分解→银白色 ④Na2CO3溶液中滴加酚酞→红色 ⑤鸡蛋白溶液遇浓硝酸→黄色 ⑥碘化银的悬浊液中加入硫化钠晶体,振荡后变黑 A.①②③④⑤ B.①②④⑤⑥ C.②③④⑤⑥ D.①③④⑤⑥
|
|
| 5. | 详细信息 |
|
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是( ) A.体积相等时密度相等 B.体积相等时具有的电子数相等 C.原子数相等时具有的中子数相等 D.质量相等时具有的质子数相等
|
|
| 6. | 详细信息 |
|
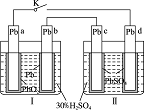
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4===2PbSO4+2H2O,研读下图,下列判断不正确的是( )。 A.K闭合时,d电极反应式:PbSO4+2H2O-2e-===PbO2+4H++SO B.当电路中转移0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol C.K闭合时,Ⅱ中SO D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为正极
|
|
| 7. | 详细信息 |
|
LiAlH4是金属储氢材料又是有机合成中的常用试剂,遇水能剧烈反应释放出氢气,LiAlH4在125 ℃分解为LiH、H2和Al。下列叙述错误的是( ) A.LiAlH4与乙醛作用生成乙醇,LiAlH4作还原剂 B.1 mol LiAlH4在125 ℃完全分解,转移3 mol电子 C.LiAlH4与D2O反应,所得氢气的摩尔质量为4 g·mol-1 D.LiAlH4与水反应生成三种物质时, 化学方程式可表示为:LiAlH4+4H2O===Al(OH)3+LiOH+4H2↑
|
|
| 8. | 详细信息 |
|
反应N2O4(g) A.A、C两点的反应速率:A>C B.A、C两点气体的颜色:A深,C浅 C.A、C两点气体的平均相对分子质量:A>C D.由状态B到状态A,可以用加热的方法
|
|
| 9. | 详细信息 |
|
已知当NH4Cl溶液的浓度小于0.1mol/L时,其pH>5.1。现用0.1mol/L的盐酸滴定10mL0.05mol/L的氨水,用甲基橙作指示剂达到终点时所用盐酸的量应是( ) A.10mL B.5mL C. 小于5mL D. 大于5mL
|
|
| 10. | 详细信息 |
|
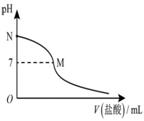
298K时,在20.0mL 0.10mol·L-氨水中滴入0.10mol·L-的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10mol·L-氨水的电离度为1.32%,下列有关叙述正确的是( )
B.M点对应的盐酸体积为20.0mL C.M点处的溶液中C(NH4+)=C(Cl-)=C(H+)=C(OH-) D.N点处的溶液中pH<12
|
|
| 11. | 详细信息 |
|
现有12 mL浓度为0.05 mol·L-1的Na2SO3溶液恰好与10 mL浓度为0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3可被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为( ) A.+1 B.+2 C.+3 D.+4
|
|
| 12. | 详细信息 |
|
帅boy和美girl们每天早晨六点就会起床背化学方程式,而丑的人九点以后才会被憋醒,那么下列表示溶液中发生反应的化学方程式错误的是( ) A.2Al+2NaOH+2H2O === 2NaAlO2+3H2↑ B.2KMnO4+HCOOK+KOH === 2K2MnO4+CO2↑+H2O C.MnO2+4HCl(浓) D.K2Cr2O7+6FeSO4+7H2SO4=== Cr2(SO4)3 +3Fe2(SO4)3 +K2SO4+7H2O
|
|
| 13. | 详细信息 |
|
有关碱金属的叙述正确的是 ( ) A.随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大 B.碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应 C.碳酸铯加热时不能分解为二氧化碳和氧化铯 D.无水硫酸铯的化学式为Cs2SO4,它不易溶于水
|
|
| 14. | 详细信息 |
|
亚氯酸钠(NaClO2)用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点。其在溶液中可生成ClO2、HClO2、ClO2-、Cl- 等,其中HClO2和ClO2都具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析错误的是( ) A.HClO2的电离平衡常数的数值Ka=10-6 B.亚氯酸钠在碱性条件下较稳定 C.pH=7时,溶液中含氯微粒的浓度大小为: c(HClO2)>c(ClO2- )> c( ClO2) >c( Cl-) D.同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有 c(HClO2)+ 2c(H+) = c(ClO2-)+ 2c(OH-)
|
|
| 15. | 详细信息 |
|
硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有比能量高、产物清洁无污染和燃料易于储存和运输等优点, 被认为是一种很有发展潜力的燃料电池,其工作原理如下图所示,下列说法正确的是( ) A.电极a采用MnO2,MnO2既作电极材料又有催化作用 B.放电时,每转移2mol电子,理论上需要消耗9.5gNaBH4 C.电池放电时Na+从b极区移向a极区 D.电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
|
|
| 16. | 详细信息 |
|
将足量的CO2通入下列各溶液中,所含离子还能大量共存的是( ) A.K+、SiO32-、Cl-、NO3- B.H+、NH4+、Al3+、SO42- C.Na+、S2-、OH-、SO42- D.Na+、C6H5O-、CH3COO-、HCO3-
|
|
| 17. | 详细信息 |
|
室温下,将1 mol的CuSO4·5H2O(s)溶于水会使溶液温度降低,热效应为ΔH1,将1 mol的CuSO4溶于水会使溶液温度升高,热效应为ΔH2;CuSO4(s)·5H2O(s)受热分解的化学方程式为CuSO4·5H2O(s) A.ΔH2>ΔH3 B.ΔH1<ΔH3 C.ΔH1+ΔH3=ΔH2 D.ΔH1+ΔH2>ΔH3
|
|
| 18. | 详细信息 |
|
溴化碘(IBr)的化学性质与卤素单质相似,能与大多数金属反应生成金属卤化物,和某些非金属单质反应生成相应的卤化物,跟水反应的方程式IBr+H2O===HBr+HIO,下列有关IBr的叙述中,不正确的是 ( ) A.IBr是双原子分子 B.在很多反应中,IBr是强氧化剂 C.和水反应时,既是氧化剂又是还原剂 D.和NaOH溶液反应生成NaBr和NaIO
|
|
| 19. | 详细信息 |
|
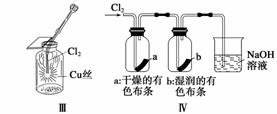
某同学用下列装置制备并检验Cl2的性质。
下列说法正确的是 ( ) A.Ⅰ图中:如果MnO2过量,浓盐酸就可全部被消耗 B.Ⅱ图中:量筒中发生了加成反应 C.Ⅲ图中:发生的反应不是燃烧反应 D.Ⅳ图中:湿润的有色布条能褪色,将硫酸溶液滴入烧杯中,至溶液显酸性,结果有Cl2生成
|
|
| 20. | 详细信息 |
|
取a g某物质在O2中完全燃烧,将生成物与足量Na2O2固体完全反应,反应后,固体质量恰好也增加了a g,下列物质不能满足上述结果的是 ( ) A.H2 B.CO C.C12H22O11 D.C6H12O6
|
|
| 21. | 详细信息 |
|
将4.0 mol PCl3和2.0 mol Cl2充入体积不变的密闭容器中,在一定条件下发生下述反应:PCl3(g)+Cl2(g) A.0.6 mol B.0.3 mol C.小于0.3 mol D.大于0.3 mol,小于0.6 mol
|
|
| 22. | 详细信息 |
|
某温度下,向一定体积0.1 mol·L-1的醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH(pOH=-lg[OH-])与pH的变化关系如图所示,则( ) A.M点所示溶液的导电能力强于Q点 B.N点所示溶液中c(CH3COO-)>c(Na+) C.M点和N点所示溶液中水的电离程度相同 D.Q点消耗NaOH溶液的体积等于醋酸溶液的体积
|
|
| 23. | 详细信息 |
|
相同温度、相同浓度下的八种溶液,其pH由小到大的顺序如图所示,图中①②③④⑤代表的物质可能分别为( )
A.NH4Cl (NH4)2SO4 CH3COONa NaHCO3 NaOH B.(NH4)2SO4 NH4Cl CH3COONa NaHCO3 NaOH C.(NH4)2SO4 NH4Cl NaOH CH3COONa NaHCO3 D.CH3COOH NH4Cl (NH4)2SO4 NaHCO3 NaOH
|
|
| 24. | 详细信息 |
|
将足量BaCO3分别加入: ①30 mL水②10 mL 0.2 mol·L-1 Na2CO3溶液 ③50 mL 0.01 mol·L-1氯化钡溶液④100 mL 0.01 mol·L-1盐酸中溶解至溶液饱和。各溶液中Ba2+的浓度由大到小的顺序为( ) A.①②③④ B. ④③①② C. ③④①② D.②①④③
|
|
| 25. | 详细信息 |
|
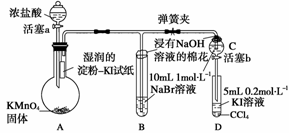
为验证卤素单质氧化性的相对强弱,某小组用下图所示装置进行实验(夹持仪器已略去,气密性已检验)。
实验过程: Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。 Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。 Ⅲ.当B中溶液由黄色变为棕红色时,关闭活塞a。 Ⅳ.…… (1)A中产生黄绿色气体,其电子式是_______________________________________。 (2)验证氯气的氧化性强于碘的实验现象是____________________________________ ________________。 (3)B中溶液发生反应的离子方程式是_______________________________________。 (4)为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 操作:__________________________________________________________________ 现象:_________________________________________________________________。 (5)过程Ⅲ实验的目的是_________________________________________________。 (6)氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下________,得电子能力逐渐减弱。
|
|
| 26. | 详细信息 |
|
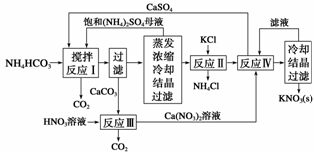
KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为_______________________________________________________________。 (2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是________________________________________________________; (3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,_______________________________________________________________________。 (4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有_______、______ (填化学式)。
|
|
| 27. | 详细信息 |
|
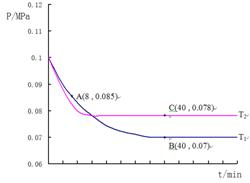
2013年,“雾霾”成为年度关键词。近年来,对“雾霾”的防护与治理成为越来越重要的环境问题和社会问题。雾霾主要由二氧化硫、氮氧化物和可吸入颗粒物这三项组成。 (1)机动车的尾气是雾霾形成的原因之一,近几年有人提出利用选择性催化剂利用汽油中挥发出来的C3H6催化还原尾气中的NO气体,请写出该过程的化学方程式: __________________________________________ (2)我国北方到了冬季烧煤供暖所产生的废气也是雾霾的主要来源之一。经研究发现将煤炭在O2/CO2的气氛下燃烧,发现能够降低燃煤时NO的排放,主要反应为: 2NO(g)+2CO(g) 若① N2(g)+O2(g) ② CO(g) ③ C (s)+O2(g) 则ΔH=_____________kJ•mol-1。 (3)燃煤尾气中的SO2用NaOH溶液吸收形成NaHSO3溶液,在pH为4~7之间时电解,硫元素在铅阴极上被电解还原为Na2S2O4。Na2S2O4俗称保险粉,广泛应用于染料、印染、造纸、食品工业以及医学上。这种技术是最初的电化学脱硫技术之一。请写出该电解反应中阴极的电极方程式:__________________________________________ (4)SO2经过净化后与空气混合进行催化氧化后制取硫酸或者硫酸铵,其中SO2发生催化氧化的反应为:2SO2(g) +O2(g)
②图中A点时,SO2的转化率为 ③计算SO2催化氧化反应在图中B点的压强平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数) ④若在T2℃,其他条件不变的情况下测得压强的变化曲线如图所示,则T1____T2(填“>”、“<”、“=”);其中C点的正反应速率vc(正)与A点的逆反应速率vA(逆)的大小关系为vc(正) ____vA(逆) (填“>”、“<”、“=”)。
|
|
| 28. | 详细信息 |
|
已知:CH3COOH (1)对于任意弱电解质来讲,其电离平衡常数Ka、对应离子的水解常数Kh以及水的离子积常数Kw的关系是______________________,由此可以推断,弱电解质的电离程度越小,其对应离子的水解程度____________(填越大、越小、不变)。 (2)由于CH3COOH的电离程度很小,计算时可将CH3COOH的平衡浓度看成是CH3COOH溶液的浓度,则c mol·L-1的CH3COOH溶液中c(H+)=________(不为0)。 (3)现用某未知浓度(设为c′)的CH3COOH溶液及其他仪器、药品,通过实验测定一定温度下CH3COOH的电离平衡常数,需测定的数据有(用简要的文字说明): ①实验时的温度; ②________________________________________________________________________; ③用____________(填一种实验方法)测定溶液浓度c′。
|
|
| 29. | 详细信息 |
|
秸秆(含多糖物质)的综合应用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:
|
|