山东省济宁市四校2017届九年级化学下学期联考模拟试题答案
| 1. | 详细信息 |
|
物质的性质决定用途,下列物质的用途中利用其物理性质的是( ) A..烹饪鱼时加入醋和料酒能去除腥味 B.液氮用作制冷剂 C.生石灰用作干燥剂 D.海水用来制碱
|
|
| 2. | 详细信息 |
|
下列有关物质粒子或图示的叙述不正确的是 A.在化学变化中,原子的核电荷数和核外电子数都不发生改变 B.未见饭菜就闻到饭菜的香味,说明物质的分子很小,且在不停地运动 C.NaOH溶于水温度升高,因为钠离子和氢氧根离子水合放出的热量大于扩散吸收的热量 D.构成金刚石、石墨、C60等碳单质的原子,其核内质子数都为6
|
|
| 3. | 详细信息 |
|
下列实验现象描述错误的是( ) A.将锌片放入少量稀硫酸中:银白色固体 B.铝丝插入硫酸铜溶液中:银白色固体表面有紫红色固体析出,溶液由蓝色变为浅绿色 C.红磷在空气中燃烧:产生大量白色烟及黄色火焰,放热 D.氯化铵与熟石灰混合研磨:白色固体中产生刺激性气味的气体
|
|
| 4. | 详细信息 |
|
下列应用、相应化学方程式和基本反应类型标注都正确的一组是( ) A. 铁在氧气中燃烧 3Fe+2O2 B. 酸雨显酸性的其一原因 H2O+SO2=H2SO3 化合反应 C.医疗上可用苏打治疗胃酸过多 Na2CO3+2HCl=2 NaCl+H2O+ CO2↑ 复分解反应 D. 证明铁的活动性比铜强 2Fe+3CuCl2=2FeCl3+3Cu 置换反应
|
|
| 5. | 详细信息 |
|
分析下列实验内容,说法正确的一组是( ) A.仅利用酚酞和稀盐酸两种试剂能将NaCl、NaOH、Na2CO3三种溶液区别开 B.实验室盛放盐酸的试剂瓶塞是橡胶塞,而盛放氢氧化钠的试剂瓶塞是玻璃塞 C.仅用氯化钙溶液可以检验出氢氧化钠是否部分变质 D.碳酸钠、水、氮气、氢氧化钠都是无机物
|
|
| 6. | 详细信息 | ||||||||||||||||||||
|
下图是干燥、收集某气体的装置。由实验装置可以推测该气体的有关性质,请你在表中找出相对应的选项。( )
|
|||||||||||||||||||||
| 7. | 详细信息 |
|
a、b、c 三种物质的溶解度曲线如下图所示。取等质量t2℃的 a、b、c 三种物质的饱和溶液,分别蒸发等量水后恢复至t2℃。下列说法不正确的是( ) A.原饱和溶液中,溶质的质量分数 a>b=c B.恢复至 t2℃时,析出溶质的质量 a>b=c C.恢复至t2℃时,三种溶液一定都是 D.若继续降温至 t1℃,三种溶液一定都是饱和溶液
|
|
| 8. | 详细信息 |
|
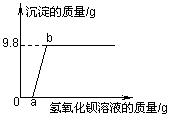
某溶液可能含有盐酸、硫酸、硝酸钠、氯化铜中的一种或几种,为了探究其组成,向一定
B.该溶液一定含有盐酸、氯化铜,可能含有硝酸钠 C.反应过程生成的沉淀一定有氢氧化铜,可能有硫酸钡 D.到达b点时所消耗氢氧化钡溶液中溶质的质量是17.1g
|
|
| 9. | 详细信息 |
|
“科学认识”确保健康,生活中的下列做法,你认为合理的是( )
|
|
| 10. | 详细信息 | |||
|
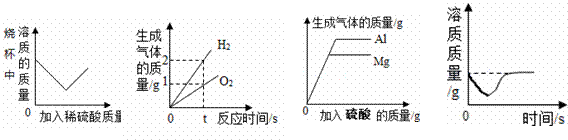
下列图象能正确反映实验过程中相应量变化的是( )
A B C D A. 向烧杯内一定量的氢氧化钡溶液中不断加入稀硫酸 B. 通电分解水 C. 分别向24g镁和23g铝中逐渐加入等溶质质量分数的稀硫酸 D. 向一定量饱和石灰水中加入少量生石灰固体
|
||||
| 11. | 详细信息 |
|
请用你具备的化学知识回答下面问题: (1) 收集氢气时用向下排空气法或者排水法 原因是_____________; (2) 用沙子熄灭篝火 主要利用的是________________; (3) 暖气片表面常刷“银粉”(主要成分是铝) 利用的是________________; (4) 夏天铁轨之间的缝隙变小 微观原因是________________________。
|
|
| 12. | 详细信息 |
|
请按要求用化学用语完成下面问题: (1) 标出过氧碳酸钠( 化学式:2Na2CO3·3H2O2 )中氧元素的化合价____________; (2) 由H、C、O、Ca四种元素组成的一种盐的化学式________________________; (3)一种蓝色的碱_______________; (4) 黄铜的主要成分_____________。
|
|
| 13. | 详细信息 |
|
水能灭火,也能生火,李老师给同学们表演了“水能生火”的魔术(如图):他将包有过氧化氢(Na2O2)粉末的脱脂棉放在石棉网上,向脱脂棉上滴了几滴水,脱脂棉立即燃烧起来,查阅资料知道:过氧化钠与水反应生成的产物只有两种,都是初中化学常见的物质,根据所学化学知识回答: (1)脱脂棉发生了燃烧,从燃烧条件分析可知:过氧化钠和水发生反应生成了可以支持燃烧的物质 (写化学式),反应 (填“吸收”或“放出”)大量的热. (2)将反应后的化合物加到酚酞溶液中,发现酚酞溶液变红了,请根据以上信息析出过氧化钠与水反应的化学方程式 . (3)从海水中提取溴常用吹出法,即用氯气将海水里溴化钠(NaBr)中的溴置换出来,再用空气或水蒸气吹出溴(Br2).写出氯气置换出溴单质的化学方程式:________________;该反应要在pH=3的酸性条件下进行,可用________测定反应液的酸碱度.
|
|
| 14. | 详细信息 |
|
A.CCl4、H2 B.CCl4、HCl C.CH2、Cl2 D.C、HCl
|
|
| 15. | 详细信息 |
|
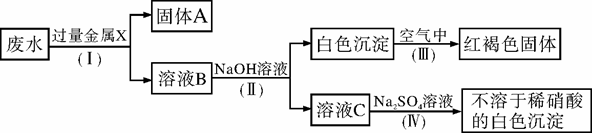
某化工厂排出的废水透明、澄清、略显蓝色。一同学取少量废水,加入过量的盐酸,有不溶于稀硝酸的白色沉淀生成。过滤,所得的滤液分成两份,一份滤液中加入稀硫酸,也有不溶于稀硝酸的白色沉淀生成;另一份滤液中加入氢氧化钠溶液,产生蓝色沉淀。试回答: (1)废水中一定含有的物质是__________(填字母)。 A.氯化物 B.硫酸盐 (2)该同学设计了一个从废水中除去重金属离子的实验方案如下[已知白色的Fe(OH)2固体在潮湿的空气中可生成红褐色的Fe(OH)3]: ①金属X为__________,固体A中一定含有的物质为__________(写化学式)。 ②B溶液中的溶质一定含有________________(填字母)。 A.K2CO3 B.Fe(NO3)2 C.MgCl2 D.Ba(NO3)2 F. Fe(NO3)3
|
|
| 16. | 详细信息 | ||||||||||
|
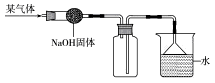
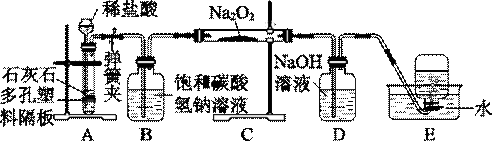
(1)(6分)探究学习小组在实验室中用下图所示装置制取 CO2 并探究CO2 与过氧化钠(Na2O2)的反应。
查阅资料得知:过氧化钠(Na2O2)是一种淡黄色固体,能与CO2、H2O 发生反应: 2Na2O2+2CO2===2Na2CO3+O2,2Na2O2+2H2O===4NaOH+O2↑。 请回答下列问题: ①装置A中发生反应的化学方程式为 ,利用装置 A 制取 CO2 的优点是 ; ②装置 B ③装置D的作用是吸收CO2,此装置中发生的反 应化 学 方 程 式 为 ; ④装置E中收集到的气体是 (填化学式),该气体还可以用下图装置中的 进行收集(填写字母序号);
a c (2)(4分)有一工业流程如下:
按要求回答下列问题: ①请将电石与水反应的化学方程 CaC2+2H2O═Ca(OH)2+ ↑. ②有关物质常温下的溶解度如表:
上述流程中加入了KCl粉末,KCl与 (填化学式)发生了复分解反应得KClO3晶体,该过程得到KClO3晶体的原因是 . ③写出向CaCl2溶液中通入两种气体生成CaCO3的化学方程式: 。
|
|||||||||||
| 17. | 详细信息 |
|
厨师在烧菜时总喜欢在加了酒之后,再放些醋,于是菜的香味就更浓了,这种炒菜的方法,有它的科学道理:酒和醋在热锅里发生了化学反应,生成乙酸乙酯(化学式为CH3COOC2H5)﹣﹣有芳香气味的物质,请计算: (1)乙酸乙酯的相对分子质量为 ; (2)乙酸乙酯中碳、氢、氧三种元素的质量比为 .
|
|
| 18. | 详细信息 |
|
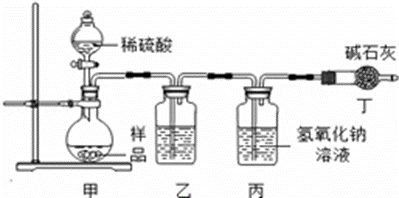
某研究性学习小组设计了测定纯碱(Na2CO3)样品(只含NaCl杂质)中Na2CO3质量分数的实验方案.请回答下列问题:
①实验装置乙中盛放的试剂为 ; ②小明同学认为小科的方案存在问题,即使操作规范下也会造成结果偏低,请你替他说说理由 (2)沉淀法. ③过滤、洗涤、干燥、称量沉淀的质量为10.0g。
|
|