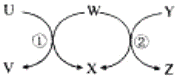2018е®үеҫҪй«ҳдёҖдёӢеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰејҖеӯҰиҖғиҜ•
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҚиғҪз”ЁжқҘйүҙеҲ«Na2CO3е’ҢNaHCO3зҡ„ж–№жі•жҳҜпјҲ пјү
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺзү©иҙЁзҡ„йҮҸжө“еәҰиЎЁиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
жҹҗж°ҜеҢ–й•Ғжә¶ж¶Ізҡ„еҜҶеәҰдёә1.18gвҖўcmп№Ј3 пјҢ е…¶дёӯй•ҒзҰ»еӯҗзҡ„иҙЁйҮҸеҲҶж•°дёә5.1%пјҢеҲҷ300mLиҜҘжә¶ж¶ІдёӯClп№Јзҡ„зү©иҙЁзҡ„йҮҸзәҰзӯүдәҺпјҲВ В пјү C.0.74 molВ В D.1.50 mol
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
1gN2еҗ«жңүxдёӘN2 пјҢ еҲҷйҳҝдјҸеҠ еҫ·зҪ—еёёж•°дёәпјҲВ В пјү
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—зү©иҙЁдёӯеұһдәҺзәҜеҮҖзү©зҡ„жҳҜпјҲВ пјү
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
е°Ҷ2.56g Cuе’ҢдёҖе®ҡйҮҸзҡ„жө“HNO3еҸҚеә”пјҢйҡҸзқҖCuзҡ„дёҚж–ӯеҮҸе°‘пјҢеҸҚеә”з”ҹжҲҗж°”дҪ“зҡ„йўңиүІйҖҗжёҗеҸҳжө…пјҢеҪ“CuеҸҚеә”е®ҢжҜ•ж—¶пјҢе…ұ收йӣҶеҲ°ж°”дҪ“1.12LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҢеҲҷеҸҚеә”дёӯж¶ҲиҖ—HNO3зҡ„зү©иҙЁзҡ„йҮҸдёәпјҲВ В пјү
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
ж—Ҙжң¬ең°йңҮеј•иө·зҡ„ж ёеҸҚеә”е ҶзҲҶзӮёпјҢеҜ№жҲ‘еӣҪд№ҹдә§з”ҹдәҶдёҖе®ҡзҡ„еҪұе“ҚпјҢе…¶дёӯжңү131IгҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ В пјү
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜ( )
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
з“Ұж–Ҝдёӯз”Ізғ·дёҺж°§ж°”зҡ„иҙЁйҮҸжҜ”дёә1пјҡ4ж—¶жһҒжҳ“зҲҶзӮёпјҢжӯӨж—¶з”Ізғ·дёҺж°§ж°”зҡ„дҪ“з§ҜжҜ”дёәпјҲВ В пјү
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺе…ғзҙ еҸҠе…¶еҢ–еҗҲзү©зҡ„иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—дәӢе®һдёҺиғ¶дҪ“жҖ§иҙЁж— е…ізҡ„жҳҜпјҲВ В пјү
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ |
|
.жңүдёҖзңҹз©ә瓶иҙЁйҮҸдёәm1 пјҢ иҜҘ瓶充е…Ҙз©әж°”еҗҺиҙЁйҮҸдёәm2 пјҺ еңЁзӣёеҗҢзҠ¶еҶөдёӢпјҢиӢҘж”№дёәе……е…Ҙжҹҗж°”дҪ“Aж—¶пјҢжҖ»иҙЁйҮҸдёәm3 пјҺ еҲҷAзҡ„зӣёеҜ№еҲҶеӯҗиҙЁйҮҸжҳҜпјҲВ В пјү
|
|
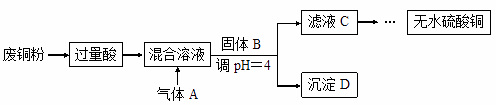
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
.жҹҗеҗҢеӯҰжӢҹз”Ёеҗ«е°‘йҮҸFe2O3жқӮиҙЁзҡ„еәҹй“ңзІүеҲ¶еӨҮж— ж°ҙзЎ«й…ёй“ңпјҢи®ҫи®ЎдәҶеҰӮдёӢжөҒзЁӢпјҡ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁNAиЎЁзӨәйҳҝдјҸдјҪеҫ·зҪ—еёёж•°зҡ„еҖјпјҺдёӢеҲ—еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜпјҲВ пјү
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
дёҖе®ҡйҮҸзҡ„CuSе’Ң Cu2Sзҡ„ж··еҗҲзү©жҠ•е…Ҙи¶ійҮҸзҡ„зЎқй…ёдёӯпјҢ收йӣҶеҲ°ж°”дҪ“VL(ж ҮеҮҶзҠ¶еҶө)пјҢеҗ‘еҸҚеә”еҗҺзҡ„жә¶ж¶Ідёӯ( A. 18.0LВ В В B. 27.0LВ В В C. 3
|
|
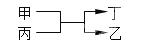
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
иӢҘз”ІгҖҒд№ҷдёәзҹӯе‘ЁжңҹгҖҒеҗҢдёҖдё»ж—Ҹе…ғзҙ з»„жҲҗзҡ„еҚ•иҙЁ,дёҷгҖҒдёҒйғҪжҳҜз”ұдёӨз§Қе…ғзҙ з»„жҲҗзҡ„еҢ–еҗҲзү©,е®ғ们д№Ӣй—ҙжңүеҰӮдёӢеӣҫжүҖзӨәзҡ„иҪ¬еҢ–е…ізі»,еҲҷж»Ўи¶іжқЎд»¶зҡ„з”Іе’Ңд№ҷеҸҜд»ҘдёәпјҲВ В пјүВ
A. й’ е’Ңж°ўж°”В В В B. зЎ«е’Ңж°§ж°”В В В C. зўіе’ҢзЎ…В В В D. ж°Ҝж°”е’Ңжәҙ
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||||||||
|
еӣҫдёӯUпӮ®Zе…ӯз§Қзү©иҙЁеңЁйҖӮеҪ“жқЎд»¶дёӢиғҪе®һзҺ°еӣҫзӨәз®ӯеӨҙж–№еҗ‘дёҖжӯҘиҪ¬еҢ–пјҢдё”еҸҚеә”в‘ гҖҒв‘ЎеқҮдёәзҪ®жҚўеҸҚеә”пјҢж»Ўи¶іжқЎд»¶зҡ„зү©иҙЁз»„жҳҜпјҲВ В В пјү
A. в‘Ўв‘ЈВ В В B. в‘Ўв‘ўВ В В C. в‘ в‘Ўв‘ЈВ В В D. в‘ в‘Ўв‘ўв‘Ј
|
|||||||||||||||||||||||||||
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹжҙ»еҜҶеҲҮзӣёе…ігҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. д№ҷзғҜеҸҜз”ЁдҪңж°ҙжһңзҡ„еӮ¬зҶҹеүӮ B. дәҢж°§еҢ–зЎ«еҸҜз”ЁдҪңйЈҹе“Ғзҡ„жјӮзҷҪеүӮ C. дәӨиӯҰеҸҜз”Ёй…ёжҖ§йҮҚ铬酸й’ҫжқҘжЈҖжөӢеҸёжңәжҳҜеҗҰй…’й©ҫ D. з”Ёж–°еҲ¶зҡ„ж°ўж°§еҢ–й“ңеҸҜд»ҘжЈҖйӘҢе°ҝж¶Ідёӯзҡ„и‘Ўиҗ„зі–
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢзЎқй…ёж—ўиЎЁзҺ°й…ёжҖ§пјҢеҸҲиЎЁзҺ°ж°§еҢ–жҖ§зҡ„жҳҜ A. Fe2O3и·ҹзЁҖзЎқй…ёеҸҚеә”В В В B. Fe(OH)2и·ҹзЁҖзЎқй…ёеҸҚеә” C. CuOи·ҹзЁҖзЎқй…ёеҸҚеә”В В В D. Al(OH)3и·ҹзЁҖзЎқй…ёеҸҚеә”
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
.дёӢеҲ—жңүе…іеҢ–еӯҰз”ЁиҜӯдҪҝз”ЁжӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. ж¬Ўж°Ҝй…ёзҡ„з»“жһ„ејҸпјҡHвҖ”ClвҖ”OВ В В B. CO2зҡ„жҜ”дҫӢжЁЎеһӢ C. NH4Clзҡ„з”өеӯҗејҸпјҡ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ұCO2гҖҒH2з»„жҲҗзҡ„ж··еҗҲж°”еңЁеҗҢжё©гҖҒеҗҢеҺӢдёӢдёҺж°®ж°”зҡ„еҜҶеәҰзӣёеҗҢгҖӮеҲҷиҜҘж··еҗҲж°”дҪ“дёӯCO2гҖҒH2ж°”дҪ“зҡ„дҪ“з§ҜжҜ”дёәпјҲВ В В пјү A. 29вҲ¶8В В В B. 22вҲ¶1В В В C. 13вҲ¶8В В В D. 8вҲ¶13
|
|
| 22. | иҜҰз»ҶдҝЎжҒҜ | |||||||||||||||
|
дёӢиЎЁдёӯе®һйӘҢвҖңж“ҚдҪңе’ҢзҺ°иұЎвҖқдёҺвҖңз»“и®әвҖқеҜ№еә”е…ізі»жӯЈзЎ®зҡ„дёҖз»„жҳҜ(гҖҖгҖҖ)
A. AВ В В B. BВ В В C. CВ В В D. D
|
||||||||||||||||
| 23. | иҜҰз»ҶдҝЎжҒҜ |
|
.дёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В В пјү A. ж— ж°ҙCaCl2еҸҜз”ЁдәҺе№ІзҮҘH2гҖҒCl2е’ҢNH3 B. ж— ж°ҙзЎ«й…ёй“ңдёҺиғҶзҹҫзҡ„зӣёдә’иҪ¬еҢ–еұһдәҺеҢ–еӯҰеҸҳеҢ– C. д»Јжӣҝдј з»ҹзҒ«иҚҜйһӯзӮ®зҡ„вҖңз”өеӯҗйһӯзӮ® D. еҲ¶йҖ е…үеҜјзәӨз»ҙзҡ„дё»иҰҒжқҗж–ҷдёәжҷ¶дҪ“зЎ…
|
|
| 24. | иҜҰз»ҶдҝЎжҒҜ |
|
.еңЁж ҮеҮҶзҠ¶еҶөдёӢпјҢдёӢеҲ—еӣӣз§Қж°”дҪ“зҡ„е…ізі»дёӯпјҢд»ҺеӨ§еҲ°е°Ҹзҡ„йЎәеәҸжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү в‘ 6.72LCH4в‘Ў3.01Г—1 A. дҪ“з§Ҝпјҡв‘Ј>в‘ >в‘Ў>в‘ўВ В В B. ж°ўеҺҹеӯҗж•°пјҡв‘ >в‘Ў>в‘ў>в‘Ј C. иҙЁйҮҸпјҡв‘Ў>в‘ >в‘ў>в‘ЈВ В В D. еҜҶеәҰпјҡв‘Ў>в‘ў>в‘Ј>в‘
|
|
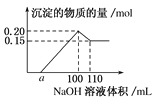
| 25. | иҜҰз»ҶдҝЎжҒҜ |
|
.жҹҗе®һйӘҢе°Ҹз»„еҜ№дёҖеҗ«жңүAl3пјӢзҡ„жңӘзҹҘжә¶ж¶ІиҝӣиЎҢдәҶеҰӮдёӢеҲҶжһҗпјҡпјҲ1пјүж»ҙеҠ е°‘йҮҸNaOHжә¶ж¶ІпјҢж— жҳҺжҳҫеҸҳеҢ–пјӣпјҲ2пјү继з»ӯж»ҙеҠ NaOHжә¶ж¶ІпјҢжңүзҷҪиүІиғ¶зҠ¶жІүж·Җз”ҹжҲҗпјӣпјҲ3пјүж»ҙеҠ иҝҮйҮҸзҡ„NaOHжә¶ж¶ІпјҢзҷҪиүІиғ¶зҠ¶жІүж·ҖжҳҺжҳҫеҮҸе°‘гҖӮе®һйӘҢе°Ҹз»„з»Ҹе®ҡйҮҸеҲҶжһҗпјҢеҫ—еҮәеҰӮеӣҫжүҖзӨәжІүж·Җзҡ„зү©иҙЁзҡ„йҮҸдёҺж»ҙеҠ NaOHжә¶ж¶ІдҪ“з§Ҝзҡ„е…ізі»гҖӮдёӢеҲ—иҜҙжі•й”ҷиҜҜзҡ„жҳҜ(гҖҖгҖҖ)
A. иҜҘжңӘзҹҘжә¶ж¶ІдёӯиҮіе°‘еҗ«жңү3з§ҚйҳізҰ»еӯҗ B. NaOHжә¶ж¶Ізҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёә5 molВ·LпјҚ1 C. иӢҘеҸҰдёҖз§ҚзҰ»еӯҗдёәдәҢд»·йҳізҰ»еӯҗпјҢеҲҷaпјқ10 D. иӢҘе°ҶжңҖз»ҲжІүж·ҖиҝҮж»ӨгҖҒжҙ—ж¶ӨгҖҒзҒјзғ§пјҢе…¶иҙЁйҮҸдёҖе®ҡдёә6 g
|
|
| 26. | иҜҰз»ҶдҝЎжҒҜ |
|
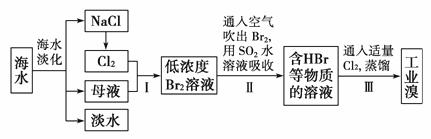
жө·ж°ҙжҳҜе·ЁеӨ§зҡ„иө„жәҗе®қеә“пјҢд»Һжө·ж°ҙдёӯ
|
|
| 27. | иҜҰз»ҶдҝЎжҒҜ |
|
AгҖҒBгҖҒCгҖҒDгҖҒEжҳҜй«ҳдёӯйҳ¶ж®өеӯҰд№ зҡ„еёёи§ҒеҚ•иҙЁжҲ–еҢ–еҗҲзү©пјҢеҚ•иҙЁAеңЁеҚ•иҙЁBдёӯзҮғзғ§дә§з”ҹиӢҚзҷҪиүІзҡ„зҒ«з„°пјҢдә§зү©жә¶дәҺж°ҙеҫ—еҲ°еёёи§Ғзҡ„ејәй…ёгҖӮеҢ–еҗҲзү©Cе…·жңүејәж°§еҢ–жҖ§гҖҒжјӮзҷҪжҖ§пјҢжҳҜеҚ•иҙЁBдёҺж°ҙеҸҚеә”зҡ„дә§зү©д№ӢдёҖгҖӮеҢ–еҗҲзү©DжҳҜж·Ўй»„иүІзү©иҙЁпјҢеҸҜз”ЁдәҺе‘јеҗёйқўе…·пјҢеҸҜз”ұдёҖз§Қжҙ»жіјйҮ‘еұһEеңЁж°§ж°”дёӯзҮғзғ§еҫ—еҲ°гҖӮеӣһзӯ”й—®йўҳпјҡ пјҲ1пјүзү©иҙЁCзҡ„еҗҚз§°____________ пјҢеҢ–еҗҲзү©DдёӯйқһйҮ‘еұһе…ғзҙ зҡ„еҢ–еҗҲд»·дёә___________гҖӮ пјҲ2пјүеҚ•иҙЁAеңЁеҚ•иҙЁBдёӯзҮғзғ§зҡ„еҢ–еӯҰж–№зЁӢејҸдёә___________гҖӮ пјҲ3пјүеҚ•иҙЁBдёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸдёә___________гҖӮ пјҲ4пјүеҢ–еҗҲзү©DдёҺж°ҙеҸҚеә”зҡ„зҰ»еӯҗж–№зЁӢејҸ___________гҖӮ пјҲ5пјүжҙ»жіјйҮ‘
|
|
| 28. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||
|
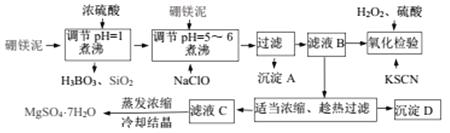
дёғж°ҙзЎ«й…ёй•ҒпјҲMgSO4В·7H2OпјүеҸҜз”ЁдәҺеҚ°жҹ“еҠ йҮҚ зЎјй•ҒжіҘеҲ¶еҸ–дёғж°ҙзЎ«й…ёй•Ғзҡ„е·ҘиүәжөҒзЁӢеӣҫеҰӮдёӢпјҡ
иЎЁlпјҡйғЁеҲҶйҳізҰ»еӯҗејҖеҘҪжҲҗж·Җе’Ңе®Ңе…ЁжІүж·Җж—¶жә¶ж¶Ізҡ„
жҚ®жӯӨиҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҶҷеҮәз”ҹжҲҗH3BO3зҡ„зҰ»еӯҗж–№зЁӢејҸ______________гҖӮ пјҲ2пјүNaClOе…·жңүејәж°§еҢ–жҖ§пјҢиғҪзӣҙжҺҘе°Ҷжә¶ж¶ІдёӯFe2+е’ҢMn2+еҲҶеҲ«ж°§еҢ–жҲҗ______пјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ пјҲ3пјүиғҪеҗҰзӣҙжҺҘжҺ§еҲ¶pHйҷӨеҺ»Mn2+______пјҢзҗҶз”ұ__________гҖӮ пјҲ4пјүиӢҘжЈҖйӘҢж—¶жә¶ж¶Іе‘ҲзәўиүІпјҢиҜҙжҳҺж»Өж¶ІBдёӯиҝҳеҗ«жңү_______жңӘйҷӨе°ҪпјҲеЎ«зҰ»еӯҗз¬ҰеҸ·пјүпјҢеә”иЎҘеҠ _______еҶҚз…®жІёи¶ҒзғӯиҝҮж»ӨпјҲеЎ«еҢ–еӯҰејҸпјүгҖӮ пјҲ5пјүжІүж·ҖDзҡ„еҢ–еӯҰејҸ_______________гҖӮ
|
|||||||||||||||||||
| 29. | иҜҰз»ҶдҝЎжҒҜ |
|
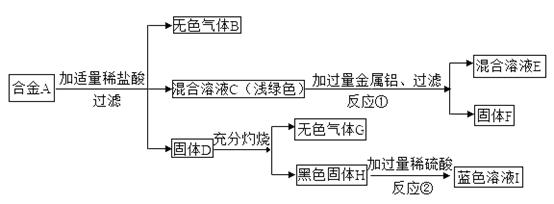
еҗҲйҮ‘Aз”ұеӣӣз§ҚеҚ•иҙЁз»„жҲҗпјҢе·ІзҹҘпјҡв‘ еҗҲйҮ‘AдёӯдёҚеҗ«KгҖҒCaгҖҒNaпјӣв‘Ўж°”дҪ“BеҸҜзҮғпјӣв‘ўж°”дҪ“GдёәдәәдҪ“ж–°йҷҲд»Ји°ўзҡ„дё»иҰҒдә§зү©д№ӢдёҖпјҢиҜ·жҚ®еӣҫеӣһзӯ”д»ҘдёӢй—®йўҳпјҡ
пјҲ1пјүеҗҲйҮ‘Aз”ұе“ӘдәӣеҚ•иҙЁз»„жҲҗ(з”ЁеҢ–еӯҰејҸиЎЁзӨә)пјҡ_____гҖҒ_______гҖҒ________гҖҒ________пјӣ пјҲ2пјүеҶҷеҮәеҸҚеә”в‘ зҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ______________пјӣ пјҲ3пјүеҶҷеҮәеҸҚеә”в‘Ўзҡ„еҢ–еӯҰж–№зЁӢејҸпјҡ__________________гҖӮ
|
|
| 30. | иҜҰз»ҶдҝЎжҒҜ |
|
з”ЁCuи·ҹжө“H2SO4еҸҚеә”пјҢеҫ—еҲ°SO2зҡ„дҪ“з§Ҝдёә22.4LпјҲж ҮеҮҶзҠ¶еҶөпјүпјҺжҠҠжүҖеҫ—зҡ„CuSO4й…ҚеҲ¶жҲҗ500mLжә¶ж¶ІпјҺжұӮпјҡ
|
|
- ж–°з–Ҷй«ҳдёҖеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёҠжңҹпјүзҪ‘дёҠиҖғиҜ•з»ғд№
- жұҹиҘҝзңҒе®ңжҳҘеёӮе®ңдё°еҺҝдәҢдёӯ2020еұҠй«ҳдёүеүҚеҚҠжңҹ第дёҖж¬ЎжңҲиҖғеҢ–еӯҰиҜ•еҚ·еёҰеҸӮиҖғзӯ”жЎҲе’Ңи§Јжһҗ
- з»ҝжҳҘеҺҝй«ҳзә§дёӯеӯҰй«ҳдёҖеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•иҖғйўҳеҗҢжӯҘи®ӯз»ғ
- жұҹиҘҝй«ҳдёҖеҢ–еӯҰжңҲиҖғжөӢйӘҢпјҲ2019е№ҙдёӢжңҹпјүйҷ„зӯ”жЎҲдёҺи§Јжһҗ
- й«ҳдёҖеҗҺеҚҠжңҹ5жңҲж®өиҖғеҢ–еӯҰдё“йўҳи®ӯз»ғпјҲ2019-2020е№ҙжұҹиҘҝзңҒж–°дҪҷеёӮ第дёҖдёӯеӯҰпјү
- 2018е№ҙиҮі2019е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳејҖеҚ·жңүзӣҠ WordзүҲеҗ«зӯ”жЎҲпјҲеҗүжһ—зңҒиҲ’е…°еёӮдёҖдёӯпјү
- зҰҸе»әзңҒйҫҷеІ©еёӮиҝһеҹҺеҺҝ第дёҖдёӯеӯҰ2020-2021е№ҙй«ҳдәҢдёҠеҚҠжңҹжңҹдёӯиҖғиҜ•еҢ–еӯҰйўҳеёҰзӯ”жЎҲе’Ңи§Јжһҗ
- ж№–еҢ—зңҒйҫҷжіүдёӯеӯҰгҖҒжҪңжұҹдёӯеӯҰ2020еұҠй«ҳдёү12жңҲиҒ”иҖғзҗҶз»јеҢ–еӯҰе…Қиҙ№иҜ•еҚ·