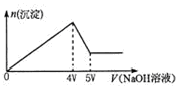2018高三上学期人教版高中化学月考试卷
| 1. | 详细信息 |
|
用NA表示阿伏加德罗常数,下列说法正确的是: A常温常压下,22.4 L CCl4含有NA个CCl4分子 B1 mol羟基中电子数为10NA C12 g金刚石中含有的共价键数为2NA D1 L 0.1 mol·L-1氨水含有0.1NA个OH-
|
|
| 2. | 详细信息 |
|
有关实验的叙述,正确的是 ( ) A.将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 B.读取滴定管内液体的体积,俯视读数导致读数偏小 C.用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应 D.用玻璃棒蘸取溶液,点在湿润的pH试纸上测定其pH
|
|
| 3. | 详细信息 |
|
下列说法在一定条件下可以实现的是( ) ①酸性氧化物与碱反应 ②弱酸与盐溶液反应不可能生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液呈中性 ⑤有单质参加的非氧化还原反应 ⑥两种含氧化合物反应的产物有气体. A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
|
|
| 4. | 详细信息 |
|
下列说法正确的是( ) A.Fe(OH)3胶体中逐滴加入稀硫酸,会产生沉淀而后沉淀溶解 B.胶体与其他分散系的本质区别是胶体能发生丁达尔效应 C.除去Fe(OH)3胶体中的Na+和Cl﹣可用过滤的方法 D.向NaOH溶液中慢慢滴加FeCl3饱和溶液,可制得Fe(OH)3胶体
|
|
| 5. | 详细信息 |
|
下列判断正确的是( ) A.使甲基橙呈黄色的溶液中一定存在K+、Ba2+、AlO2﹣、Cl﹣ B.同一主族元素气态氢化物中,相对分子质量越大,沸点越高 C.Al2O3与AlCl3虽然所含的化学键类型不同,但都属于强电解质 D.将过量Na2O2投入紫色石蕊溶液,溶液显蓝色,Na2O2是碱性氧化物
|
|
| 6. | 详细信息 |
|
下列各组离子在指定溶液中一定能够大量共存的是( ) A.在含有大量HCO3﹣的溶液中:Na+、NO3-、Cl﹣、AlO2﹣ B.加铝粉放出大量H2的溶液中:K+、NH4+、SO42﹣、Br﹣ C.含0.1 mol·L﹣1NO3﹣的溶液:H+、Fe2+、Mg2+、Cl﹣ D.能使甲基橙变红的溶液中:Na+、NH4+、SO4﹣、NO3﹣
|
|
| 7. | 详细信息 |
|
下列离子方程式书写正确的是( ) A.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+6I- B.亚硫酸钠溶液与双氧水混合: C.amolFeI2溶液中通入2a mol Cl2:2Fe2++4I-+3Cl2 D.硅酸钠溶液中通入过量的CO2:
|
|
| 8. | 详细信息 |
|
下列除杂质的操作中不正确的是 A.Na2CO3固体中混有少量NaHCO3:加热固体至质量恒定 B.CO2中混有HCl:将其通入NaOH溶液 C.NaHCO3溶液中混有少量Na2CO3:往该溶液中通入过量CO2气体 D.NaCl溶液中混有少量I2:加入适量CCl4,振荡,静置,分液
|
|
| 9. | 详细信息 |
|
下列有关化学与生活的说法错误的是 A.铁粉、生石灰均可作食品抗氧化剂 B.明矾、氯化铁均可作净水剂 C.牛奶、鸡蛋清均可用于重金属中毒解毒 D.碘酒、双氧水均可用于伤口消毒
|
|
| 10. | 详细信息 |
|
.下列说法正确的是( ) |
|
| 11. | 详细信息 |
|
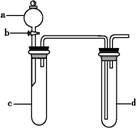
实验室制取少量干燥的氨气涉及下列装置,其中正确的是( )
A.①是氨气发生装置 B.③是氨气发生装置 C.②是氨气吸收装置 D.④是氨气收集、检验装置。
|
|
| 12. | 详细信息 |
|
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应: ①SO2+2Fe3++2H2O=SO42﹣+2Fe2++4H+ ②Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,下列有关说法正确的是( ) A.氧化性Cr2O72﹣>SO2>Fe3+ B.K2Cr2O7能将Na2SO3氧化成Na2SO4 C.每有1molK2Cr2O7参加反应,转移电子的数目为5NA D.若6.72 L SO2(标准状况)参加反应,则最终消耗0.2molK2Cr2O7
|
|
| 13. | 详细信息 |
|
向MgCl2、Al2(SO4)3的混合溶液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如图所示,则原溶液中Mg2+与Al3+的物质的量之比是( )
A.1:2 B.1:1 C.2:3 D.3:2
|
|
| 14. | 详细信息 | ||||||||||||||||||||
|
下列实验中,对应的现象、结论均正确的一组是( )
|
|||||||||||||||||||||
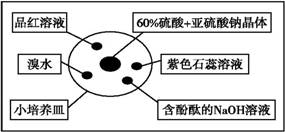
| 15. | 详细信息 |
|
如图是研究二氧化硫性质的微型实验装置。现用60%硫酸溶液和亚硫酸钠晶体反应制取SO2气体,实验现象很明显,且不易污染空气。下列说法中错误的是( )
A.含酚酞的NaOH溶液红色变浅 B.品红溶液褪色 C.溴水橙色褪去 D.紫色石蕊溶液变蓝色
|
|
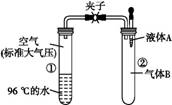
| 16. | 详细信息 |
|
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的(已知,气压减小,水的沸点降低)( )
A.氢氧化钠溶液、二氧化碳 B.盐酸、氨气 C.氢氧化钠溶液、一氧化碳 D.石灰水、二氧化硫
|
|
| 17. | 详细信息 |
|
将4.6 g Na和2.7 g Al同时加入到足量的水中充分反应,下列说法正确的是( ) A.所得溶液中阳离子和阴离子的物质的量之比为1∶2 B.反应中消耗的水的质量是加入的Al的质量的2倍 C.所得溶液中Na+和Al3+的物质的量之比为2∶1 D.反应中放出的气体在标准状况下的体积为2.24 L
|
|
| 18. | 详细信息 |
|
硝酸铜是一种重要的工业产品,化学上有很多方法可以制取硝酸铜:①将铜溶于硝酸中 ②先将铜与O2反应生成CuO,再溶于硝酸中 ③将铜溶于N2O4的乙酸乙酯(溶剂,不参加反应)溶液中生成硝酸铜和一氧化氮。下列认识或判断错误的是( ) A.方法②需要消耗能源,对环境不产生污染 B.方法①中,若从经济和环保的角度考虑,用稀硝酸比用浓硝酸好 C.方法③是最经济和环保的 D.方法③中N2O4既是氧化剂又是还原剂
|
|
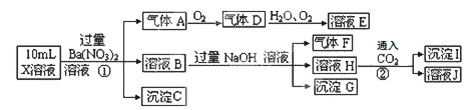
| 19. | 详细信息 |
|
某强酸性溶液X中可能含有Fe2+、A13+、NH4+、CO32―、SO32―、SO42―、C1―中的若干种,现取X溶液进行连续实验,实验过程及产物如下:
下列说法正确的是( ) A.X中肯定存在Fe2+、NH4+、SO42― B.溶液E和气体F不能发生化学反应 C.X中肯定不存在CO32―、SO32―、C1― D.沉淀I是A1(OH)3
|
|
| 20. | 详细信息 |
|
.有某硫酸和硝酸的混合溶液20 mL,其中含有硫酸的浓度为2 mol•L-1,含有硝酸的浓度为1 mol•L-1,现向其中加入0.96 g铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( ) |
|
| 21. | 详细信息 |
|
根据要求回答下列各题: (Ⅰ)现有①Na2O ②SO3 ③铁 ④蔗糖 ⑤冰醋酸(纯醋酸晶体) ⑥KNO3晶体 ⑦氢氧化钠溶液等物质,请填空回答(填序号): 以上物质在常温下(1)能导电的是 ▲ ;(2)属于非电解质的是 ▲ ; (3)属于电解质的是 ▲ ;(4)属于弱电解质的是 ▲ 。 (Ⅲ)(Ⅱ)某有机混合物4.6 g完全燃烧,将燃烧后的混合物通入过量的澄清石灰水,石灰水共增重14.2 g,经过滤得到20g沉淀.该有机样品可能是:( ) A.C2H6O2 B.CH4和C2H6的混合物 C.C2H6O和C3H8O3的混合物 D.CH4O和C3H8O的混合物
|
|
| 22. | 详细信息 | |||||||||||||||
|
现有失去标签的CaCl2、AgNO3、HCl和Na2CO3四瓶溶液。为了确定这四种溶液成分,将他们编号为A、B、C、D后进行化学实验。实验记录如下:
根据上述实验填空: (1)A、B、C三瓶溶液分别是(用化学式表示): 、 、 。 (2)写出B和D反应的离子方程式: 。
|
||||||||||||||||
| 23. | 详细信息 |
|
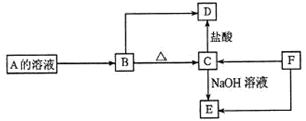
A、B、C、D、E、F为中学化学常见的六种纯净物,其中均含同一种金属元素,它们的转化关系如下图所示。A的焰色反应为紫色(透过蓝色钴玻璃观察),B、C均为难溶于水的白色固体,F为单质。(部分反应物、生成物已略去)
(1)A的化学式是________,它的一种用途是_____________;观察A的焰色时,蓝色钴玻璃的作用是_______________; (2)B的化学式是________;C→ E的化学方程式是_____________________; (3)F在酒精灯上加热时的现象是_____________________; (4)盛装NaOH溶液的试剂瓶不能用玻璃塞的原因是(用化学方程式表示)_____________。
|
|
| 24. | 详细信息 | ||||||||
|
.某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。 (2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是 。再由a向c中加2 mL蒸馏水,c中的实验现象是 。 (3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是 。 (4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ; 但此实验的不足之处是 。
|
|||||||||
| 25. | 详细信息 |
|
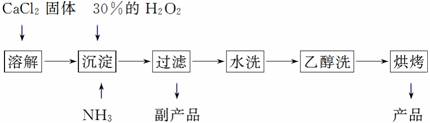
、过氧化钙可以用于改善地表水质,处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
已知CaO2·8H2O呈白色,微溶于水,加热至350 ℃左右开始分解放出氧气。 (1)用上述方法制取CaO2·8H2O的化学方程式是 ; (2)检验“水洗”是否合格的方法是 ; (3)沉淀时常用冰水控制温度在0 ℃左右,其可能原因是(写出两种): ① ;② 。 (4)测定产品中CaO2的含量的实验步骤: 第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol·L-1的H2SO4溶液,充分反应。 第二步:向上述锥形瓶中加入几滴淀粉溶液。 第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。 (已知:I2+2S2O32-===2I-+S4O62-) ①CaO2的质量分数为 (用字母表示); ②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“无影响”、 “偏低”或“偏高”),原因是 。
|
|