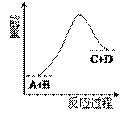2017高一下学期人教版高中化学期末考试
| 1. | 详细信息 |
|
我国成功研制的铯(133Cs)原子钟,使我国时间频率基准的精度从30万年不差1秒提高到600万年不差1秒。已知该铯原子的核外电子数为55,则该原子的中子数和质子数之差为( ) A.133 B.78 C.55 D.23
|
|
| 2. | 详细信息 |
|
化学用语是学好化学知识的重要基础,下列有关化学用语表示正确的是 ( ) ①用电子式表示HCl的形成过程: ②CCl4的电子式: ③S2- 的结构示意图: ④H、D、T互为同素异形体 ⑤次氯酸分子的结构式:H—O—Cl A.③⑤ B.①②③④⑤ C.①②③ D.③④⑤
|
|
| 3. | 详细信息 |
|
下列说法正确的是 ( ) A.伴有能量变化的物质变化都是化学变化 B.吸热反应一定需要加热才能发生 C.凡是放热反应的发生均无需加热 D.物质发生化学反应都伴随着能量变化
|
|
| 4. | 详细信息 |
|
反应A + 3B ①υ(A)= 9.0 mol/(L•min) ②υ(B)= 0.75mol/(L•s) ③υ(C)= 0.4 mol/(L•s) ④υ(D)= 0.45mol/(L•s) 则反应进行由快到慢的顺序是( ) A.①②④③ B. ④②③① C. ①④②③ D. ④③②①
|
|
| 5. | 详细信息 |
|
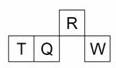
短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断正确的是( )
A.原子半径:W>Q>R B.Q的单质可以用作光导纤维 C.R的气态氢化物可与其最高价氧化物对应的水化物反应生成盐 D.T的最高价氧化物对应的水化物不能和强碱反应
|
|
| 6. | 详细信息 |
|
已知A、B、C、D均是气体,反应A+B
B.该反应是放热反应 C.当A的正反应速率与C的逆反应速率相等时处于平衡状态 D.当A、B、C、D的浓度相同时,反应处于平衡状态
|
|
| 7. | 详细信息 |
|
实验室用3.0 mol•L-1的硫酸溶液与锌粒反应制取氢气。下列措施中能加快该反应速率的是( ) A.增加锌粒的质量 B.加入少量硫酸铜 C.将所用硫酸换成98%的浓硫酸 D.加入少量醋酸钠固体
|
|
| 8. | 详细信息 |
|
目前,人类已经发现的非金属元素除稀有气体元素外共有16种,下列对这16种非金属元素的判断不正确的是( ) ①都是主族元素,原子的最外层电子数都大于3 ②单质在反应中都只能作氧化剂 ③对应的含氧酸都是强酸 ④氢化物常温下都是气态,所以又叫气态氢化物 ⑤气态氧化物与水反应都不会再生成气体 A.只有①②④⑤ B.全部 C.只有①②③ D.只有①②③④
|
|
| 9. | 详细信息 |
|
已知An+、B(n+1)+、Cn-、D(n+1)-具有相同的电子层结构。下列关于A、B、C、D四种元素的叙述中正确的是 ( ) A.气态氢化物的稳定性:D>C B.四种元素一定都属于短周期元素 C.最高价氧化物对应水化物的碱性:B>A D.原子序数:B>A>C>D
|
|
| 10. | 详细信息 |
|
下列分子中所有原子都满足最外层为8电子结构的是( ) A.SiCl4 B.H2O C.BF3 D.PCl5
|
|
| 11. | 详细信息 |
|
某学生欲通过实验判断A、B、C三块金属的活动性,做了如下实验并得到结论:当A、B与稀硫酸组成原电池时,B 极产生气泡;当B与C组成原电池时,电子方向为由B到C,据此可知这三种金属的活动性强弱顺序为( ) A.A>B>C B.A>C>B C.C>B>A D.B>C>A
|
|
| 12. | 详细信息 |
|
氢气在氧气中燃烧时产生淡蓝色火焰。在反应中,破坏1 mol 氢气中的化学键消耗能量为Q1KJ,破坏lmol氧气中的化学键消耗能量为Q2KJ,形成lmol O—H化学键释放的能量为Q3KJ。下列说法正确的是( ) A. 2Q1+Q2 < 2Q3 B. Q1+Q2 > Q3 C. 2Q1+Q2 < 4Q3 D. lmol氧气和2mol氢气的总能量低于2mol水的总能量
|
|
| 13. | 详细信息 |
|
运用元素周期律分析下面的推断,其中不正确的是( ) A.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 B.Mg(OH)2、Ba(OH)2、Ca (OH)2碱性依次增强 C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 D.锂与水反应不如钠与水反应剧烈
|
|
| 14. | 详细信息 | ||
|
某实验兴趣小组按下图装置实验后,所记录内容合理的是( )
A .①②③④ B .①②④⑤ C.①②④⑥ D.②③⑤⑥
|
|||
| 15. | 详细信息 |
|
下列有关物质性质的比较正确的是( ) ①第ⅡA族元素的单质从上到下,失电子能力增强 ②元素的最高正化合价在数值上等于它所在的族序数 ③同周期主族元素的原子半径越小,越难失去电子 ④元素的非金属性越强,它的气态氢化物水溶液的酸性越强 ⑤还原性:S2->Cl->Br- ⑥酸性:HClO4>H2SO4>H3PO4 A.①②④ B.①③⑤⑥ C.②④⑤ D.①③⑥
|
|
| 16. | 详细信息 |
|
一定条件下,在容积为5 L密闭容器中发生反应:2SO2(g)+ O2(g) A.0.004(mol•L1•min1) B.0.008(mol•L1•min1) C.0.016(mol•L1•min1) D.0.032(mol•L1•min1)
|
|
| 17. | 详细信息 |
|
在离子RO3n- 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的 中子数目是( ) A.A-x+n+24 B.A-x+n+48 C.A-x-n-24 D.A+x-n-24
|
|
| 18. | 详细信息 |
|
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌﹣锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)═Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( ) A.电池工作时,锌失去电子 B.电池正极的电极反应式为:2MnO2(s)+H2O(l)+2e﹣═Mn2O3(s)+2OH﹣(aq) C.电池工作时,溶液中的OH﹣由负极向正极移动 D.外电路中每通过0.2 mol电子,锌的质量理论上减小6.5 g
|
|
| 19. | 详细信息 |
|
(1)下列反应中,属于放热反应的是________,属于吸热反应的是________(填序号)。 ①煅烧石灰石 ②木炭燃烧 ③炸药爆炸 ④灼热的炭与CO2的反应 ⑤生石灰与水作用制熟石灰 ⑥酸碱中和 ⑦Ba(OH)2·8H2O与NH4Cl的反应 ⑧铝片与稀盐酸的反应 (2)写出碱性甲烷燃料电池的正、负极电极反应式 负极:_ ____ 正极: __。 (3)把质量相等的铜片、银片用导线连接后浸入硝酸银溶液中,构成原电池,工作一段时间后,正负极质量相差14 g,则电路中转移的电子数为 ____ 。
|
|
| 20. | 详细信息 |
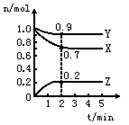
|
(1)该反应的化学方程式为 (2)反应开始至2min,以气体X表示的平均反应速率为 (3)能说明该反应已达到平衡状态的是________ a.v(X)=3v(Y) b.容器内X、Y、Z的浓度不随时间变化 c.2v逆(X)=3v正(Z) d.单位时间消耗0.3molX同时生成0.2molZ e.容器中混合气体的密度保持不变 (4)2min后反应达平衡时: ①此时体系的压强是开始时的 倍; ②达平衡时,容器内混合气体的平均分子量比起始投料时___________(填“增大”“减小”或“相等”)。
|
|
| 21. | 详细信息 |
|
有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大;①A元素最外层电子数是次外层电子数的2倍;②B的阴离子和C的阳离子与氖原子的电子层结构相同,两元素的单质反应,能生成一种淡黄色的固体Q;③D的L层电子数等于K、M两个电子层上的电子数之和。请回答以下问题: (1)E的原子结构示意图 ,B元素在周期表中的位置 (2)Q的电子式 ,其所含化学键的类型为 Q与AB2反应的化学方程式为_________________________。 (3)B、C、D、E的简单离子半径由大到小的顺序为 (用离子符号表示) (4)C与D能形成2:1的化合物,用电子式表示该化合物的形成过程 。 (5)写出D的最高价氧化物对应水化物和A单质反应的化学方程式:_____________________________________。 (6)写出实验室制取E的单质的离子方程式:
|
|
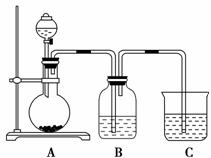
| 22. | 详细信息 |
|
某同学设计实验以探究元素性质的递变规律,实验装置如图所示:
实验Ⅰ:探究同主族元素C和Si非金属性递变规律。 已知A装置的烧瓶里装有大理石,分液漏斗里装有盐酸,B装置中装有饱和碳酸氢钠溶液,C装置中装有足量Na2SiO3溶液,试回答: (1)A中反应的离子方程式为____________________, B装置的作用是_____________________; (2)C中发生反应的化学方程式为________________________可观察到的现象是________; (3)根据实验现象推知,碳酸、盐酸、硅酸的酸性强弱顺序为___ ___ _,能否由此得出碳、氯、硅三种元素非金属性的强弱________(填“能”或“否”)并说明理由___________________。 实验Ⅱ:探究同周期元素S和Cl的非金属性强弱。已知常温下高锰酸钾与浓盐酸混合可产生氯气,B装置中装有 Na2S溶液,试回答: (4) A装置分液漏斗中所装试剂为 , B中可观察到的现象是________; (5) C装置的作用是___________________,写出C 中发生反应的离子方程式_________________________; (6) 验结论:氧化性:________,非金属性:________。
|
|