2018жІіеҚ—й«ҳдёүдёҠеӯҰжңҹдәәж•ҷзүҲй«ҳдёӯеҢ–еӯҰжңҲиҖғиҜ•еҚ·
| 1. | иҜҰз»ҶдҝЎжҒҜ |
|
еҢ–еӯҰдёҺз”ҹдә§гҖҒз”ҹжҙ»еҜҶеҲҮзӣёе…іпјҢдёӢеҲ—еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺз”ұдәҺй“қзҡ„зҶ”зӮ№иҫғдҪҺпјҢз”Ёй“қеҲ¶е®№еҷЁзғ§ж°ҙе®№еҷЁдјҡеҫҲеҝ«жә¶еҢ– BпјҺзЎқй…ёй“өж—ўеҸҜз”ЁдҪңеҢ–иӮҘпјҢд№ҹеҸҜз”ЁдәҺеҲ¶зӮёиҚҜ CпјҺж°Ёеҹәй…ёжҳҜдёҖзұ»еҲҶеӯҗдёӯйғҪеҗ«жңү-COOHе’Ң-NH2зҡ„й«ҳеҲҶеӯҗеҢ–еҗҲзү©зҡ„з»ҹз§° DпјҺзҹіжІ№жҳҜж··еҗҲзү©пјҢеҸҜйҖҡиҝҮеҲҶйҰҸеҫ—еҲ°жұҪжІ№гҖҒз…ӨжІ№зӯүзәҜеҮҖзү©
|
|
| 2. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺеҸӨзұҚдёӯзҡ„и®°иҪҪиҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺгҖҠеӨ©е·ҘејҖзү©гҖӢдёӯвҖңеҮЎзҹізҒ°пјҢз»ҸзҒ«з„ҡзӮјдёәз”ЁвҖқж¶үеҸҠзҡ„еҸҚеә”зұ»еһӢжҳҜеҲҶи§ЈеҸҚеә” BпјҺгҖҠеҗ•ж°ҸжҳҘз§ӢвҖўеҲ«зұ»зј–гҖӢдёӯвҖңйҮ‘пјҲеҚій“ңпјүжҹ”й”Ўжҹ”пјҢеҗҲдёӨжҹ”еҲҷеҲҡвҖқдҪ“зҺ°дәҶеҗҲйҮ‘зЎ¬еәҰж–№йқўзҡ„зү№жҖ§ CпјҺгҖҠжҠұжңҙеӯҗгҖӢдёӯвҖңдё№з Ӯзғ§д№ӢжҲҗж°ҙ银пјҢз§ҜеҸҳеҸҲиҝҳжҲҗдё№з ӮвҖқдёӨдёӘеҸҚеә”дә’дёәеҸҜйҖҶеҸҚеә” DпјҺгҖҠжұүд№ҰгҖӢдёӯвҖңй«ҳеҘҙеҺҝжңүжҙ§ж°ҙеҸҜзҮғвҖқпјҢиҝҷйҮҢзҡ„вҖңжҙ§ж°ҙвҖқжҢҮзҡ„жҳҜзҹіжІ№
|
|
| 3. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҖүйЎ№дёӯеүҚиҖ…дёҖе®ҡиғҪеҶіе®ҡеҗҺиҖ…зҡ„жҳҜпјҲВ В пјү AпјҺдёӨдёӘйҮ‘еұһз”өжһҒзҡ„жҙ»жіјжҖ§ејәејұвҖ”вҖ”еҺҹз”өжұ зҡ„жӯЈиҙҹжһҒ BпјҺеҸҚеә”зү©зҡ„жҖ»иғҪйҮҸе’Ңз”ҹжҲҗзү©зҡ„жҖ»иғҪйҮҸвҖ”вҖ”еҢ–еӯҰеҸҚеә”дёӯзҡ„зғӯйҮҸеҸҳеҢ– CпјҺдё»ж—Ҹе…ғзҙ еҺҹеӯҗж ёеӨ–зҡ„жңҖеӨ–еұӮз”өеӯҗж•°вҖ”вҖ”е…ғзҙ еңЁе‘ЁжңҹиЎЁдёӯзҡ„ж—ҸеәҸж•°пјҺ DпјҺдёӨз§Қй…ёзҡ„й…ёжҖ§ејәејұвҖ”вҖ”дәҢиҖ…жә¶ж¶Ізҡ„еҜјз”өжҖ§
|
|
| 4. | иҜҰз»ҶдҝЎжҒҜ |
|
е…ідәҺжҹ жӘ¬зғҜпјҲ AпјҺжҹ жӘ¬зғҜзҡ„еҲҶеӯҗејҸдёәC10H16 BпјҺжҹ жӘ¬зғҜеҲҶеӯҗдёӯжүҖжңүзўіеҺҹеӯҗдёҚеҸҜиғҪе…ұйқў CпјҺжҹ жӘ¬зғҜиғҪдҪҝжәҙж°ҙжҲ–иҖ…KMnO4й…ёжҖ§жә¶ж¶ІиӨӘиүІ DпјҺжҹ жӘ¬зғҜзҡ„еҗҢеҲҶејӮжһ„дҪ“дёӯеӯҳеңЁиҠійҰҷзғғ
|
|
| 5. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—еҸҚеә”дёӯпјҢж°§еҢ–еүӮе’ҢиҝҳеҺҹеүӮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”жңҖеӨ§зҡ„жҳҜпјҲВ В пјү AпјҺй“ңе’ҢзЁҖзЎқй…ё3Cu+8HNO3(зЁҖ)=2NOвҶ‘+3Cu(NO3)2+4H2O BпјҺж°Ҝж°”е’Ңж°Ёж°” 3Cl2+8NH3=N2+6NH4Cl CпјҺж°ўж°”е’Ңж°§еҢ–й“Ғ 3H2+Fe2O3 DпјҺдәҢж°§еҢ–й”°е’Ңзӣҗй…ё MnO2+4HCl(жө“)
|
|
| 6. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺйүҙеҲ«1 molВ·L-1зҡ„зЁҖзЎ«й…ёе’Ң98%зҡ„жө“зЎ«й…ёзҡ„еҸҷиҝ°жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺеёёжё©дёӢжөӢе®ҡдёӨжә¶ж¶Ізҡ„еҜјз”өиғҪеҠӣпјҢеҜјз”өиғҪеҠӣејәзҡ„жҳҜжө“зЎ«й…ё BпјҺеёёжё©дёӢеҸҜд»Ҙз”Ёй“ңзүҮйүҙеҲ«дёӨз§Қжә¶ж¶І CпјҺй“қзүҮдёҚиғҪз”ЁдәҺйүҙеҲ«дёӨз§Қжә¶ж¶І DпјҺдёӨжә¶ж¶Іж•һеҸЈеңЁз©әж°”дёӯж”ҫзҪ®дёҖж®өж—¶й—ҙеҗҺиҙЁйҮҸжҳҺжҳҫеўһеӨ§зҡ„жҳҜжө“зЎ«й…ё
|
|
| 7. | иҜҰз»ҶдҝЎжҒҜ |
|
В В В йҖҡиҝҮдёӢеҲ—еҸҚеә”зұ»еһӢдёҚиғҪеј•е…ҘйҶҮзҫҹеҹәзҡ„жҳҜпјҲВ В пјү AпјҺеҠ жҲҗеҸҚеә”В В В В В В В В BпјҺеҸ–д»ЈеҸҚеә” В В В В В В В CпјҺеҠ иҒҡеҸҚеә” В В В В В В В DпјҺж°ҙи§ЈеҸҚеә”
|
|
| 8. | иҜҰз»ҶдҝЎжҒҜ |
|
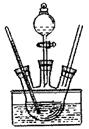
дёӢеҲ—е…ідәҺе®һйӘҢзҡ„еҸҷиҝ°й”ҷиҜҜзҡ„жҳҜпјҲВ В пјү AпјҺи’ёйҰҸеҸҜз”ЁдәҺеҲҶзҰ»жүҖжңүжІёзӮ№дёҚеҗҢзҡ„ж¶ІдҪ“зҡ„ж··еҗҲзү© BпјҺжөӢе®ҡз»“жҷ¶ж°ҙеҗ«йҮҸзҡ„е®һйӘҢдёӯеҶ·еҚҙеӣәдҪ“ж—¶еә”е°Ҷеқ©еҹҡзҪ®дәҺе№ІзҮҘеҷЁдёӯд»ҘйҒҝе…Қеҗёж”¶ж°ҙи’ёж°” CпјҺзўұзҹізҒ°дёҺжө“ж°Ёж°ҙж··еҗҲеҸҜеҝ«йҖҹеҲ¶ж°Ёж°” DпјҺж— ж°ҙзЎ«й…ёй“ңеҸҜз”ЁдәҺеҲӨж–ӯд№ҷйҶҮдёӯжҳҜеҗҰеҗ«ж°ҙ
|
|
| 9. | иҜҰз»ҶдҝЎжҒҜ |
|
и®ҫNAдёәйҳҝдјҸеҠ еҫ·зҪ—еёёж•°зҡ„ж•°еҖјпјҢдёӢеҲ—еҸҷиҝ°дёӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺ2molSO3дёҖе®ҡжқЎд»¶дёӢе……еҲҶеҲҶи§Јеҫ—еҲ°зҡ„дә§зү©еҲҶеӯҗзҡ„ж•°зӣ®дёә3NA BпјҺдёҖе®ҡйҮҸзҡ„ж— ж°ҙд№ҷйҶҮдёҺи¶ійҮҸй’ еҸҚеә”з”ҹжҲҗ5.6LH2пјҢеҲҷд№ҷйҶҮеҲҶеӯҗдёӯе…ұд»·й”®жҖ»ж•°дёә4NA CпјҺзӯүзү©иҙЁзҡ„йҮҸзҡ„ж°Ҝж°”еҲҶеҲ«дёҺи¶ійҮҸй“Ғе’Ңй“ңе®Ңе…ЁеҸҚеә”пјҢиҪ¬з§»з”өеӯҗж•°еқҮдёә2NA DпјҺж ҮеҮҶзҠ¶еҶөдёӢ22.4Lз©әж°”дёӯеҗ«жңүзҡ„еҚ•иҙЁеҲҶеӯҗж•°зӣ®е°ҸдәҺNA
|
|
| 10. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—йҖүйЎ№дёҺзӣҗзұ»ж°ҙи§Јж— е…ізҡ„жҳҜпјҲВ В пјү AпјҺж°ҜеҢ–й“Ғжә¶ж¶ІеҲ»еҲ¶еҚ°еҲ·з”өи·Ҝжқҝ В В В В В В В В В В В BпјҺжіЎжІ«зҒӯзҒ«еҷЁзҡ„еҸҚеә”еҺҹзҗҶ CпјҺж°ҜеҢ–й“өжә¶ж¶ІйҷӨй“Ғй”Ҳ В В В В В В В В В В В В В В В В В В В DпјҺйҶӢй…ёй“өжә¶ж¶ІжҳҫдёӯжҖ§
|
|
| 11. | иҜҰз»ҶдҝЎжҒҜ |
|
дёӢеҲ—е…ідәҺиҜҜе·®еҲҶжһҗзҡ„еҲӨж–ӯжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺй…ёзўұдёӯе’Ңж»ҙе®ҡдёӯж»ҙе®ҡз»ҲзӮ№иҜ»ж•°ж—¶дҝҜи§ҶдјҡдҪҝжөӢеҫ—жө“еәҰеҒҸеӨ§ BпјҺз”ЁжүҳзӣҳеӨ©е№із§°еҸ–иҚҜе“Ғж—¶иҚҜе“Ғе’Ңз қз ҒдҪҚзҪ®йў еҖ’иҚҜе“ҒиҙЁйҮҸдёҖе®ҡеҒҸе°Ҹ CпјҺй…ҚеҲ¶1 molВ·L-1зҡ„NH4NO3жә¶ж¶Іж—¶жңӘжҒўеӨҚиҮіе®Өжё©е°ұиҪ¬з§»е№¶е®ҡе®№жүҖеҫ—жә¶ж¶Іжө“еәҰеҒҸе°Ҹ DпјҺз”Ёж¶Ұж№ҝзҡ„pHиҜ•зәёжөӢж°Ёж°ҙзҡ„pHдјҡдҪҝжөӢе®ҡз»“жһңеҒҸеӨ§
|
|
| 12. | иҜҰз»ҶдҝЎжҒҜ | ||||||||||||||||||||
|
ж №жҚ®SO2йҖҡе…ҘдёҚеҗҢжә¶ж¶Ідёӯзҡ„е®һйӘҢзҺ°иұЎпјҢжүҖеҫ—з»“и®әдёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
|
|||||||||||||||||||||
| 13. | иҜҰз»ҶдҝЎжҒҜ |
|
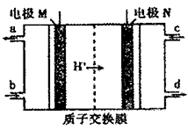
иҝ‘е№ҙжқҘжңүеӨҡдёӘе“ҒзүҢзҡ„жүӢжңәз”өжұ жӣҫеҸ‘з”ҹзҲҶзӮёдәӢж•…пјҢе…¬дј—еҜ№з”өжұ е®үе…ЁжҖ§зҡ„йҮҚи§ҶзЁӢеәҰи¶ҠжқҘи¶Ҡй«ҳпјҢзҮғж–ҷз”өжұ дҪңдёәе®үе…ЁжҖ§иғҪиҫғеҘҪзҡ„дёҖзұ»еҢ–еӯҰз”өжәҗеҫ—еҲ°дәҶжӣҙеҝ«зҡ„еҸ‘еұ•гҖӮ дёҖз§Қд»ҘиҒ”ж°Ё(N2H4)дёәзҮғж–ҷзҡ„зҺҜдҝқз”өжұ е·ҘдҪңеҺҹзҗҶеҰӮеӣҫжүҖзӨәпјҢе·ҘдҪңж—¶дә§з”ҹзЁіе®ҡж— жұЎжҹ“зҡ„зү©иҙЁгҖӮдёӢеҲ—иҜҙжі•дёҚжӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
AпјҺMжһҒз”ҹжҲҗж°®ж°”дё”з”өжһҒйҷ„иҝ‘pHйҷҚдҪҺ BпјҺиҙҹжһҒдёҠжҜҸж¶ҲиҖ—1molN2H4пјҢдјҡжңү4molH+йҖҡиҝҮиҙЁеӯҗдәӨжҚўиҶң CпјҺжӯЈжһҒзҡ„з”өжһҒеҸҚеә”ејҸдёәпјҡO2+4H++4e-=2H2O DпјҺdеҸЈжөҒеҮәзҡ„ж¶ІдҪ“жҳҜи’ёйҰҸж°ҙ
|
|
| 14. | иҜҰз»ҶдҝЎжҒҜ |
|
зҹӯе‘Ёжңҹдё»ж—Ҹе…ғзҙ XгҖҒYгҖҒZгҖҒWеҺҹеӯҗеәҸж•°е’Ңж—ҸеәҸж•°еқҮдҫқж¬ЎеўһеӨ§пјҢе…¶дёӯеҸӘжңүYгҖҒZеӨ„дәҺеҗҢдёҖе‘ЁжңҹпјҢZжҳҜз©әж°”дёӯеҗ«йҮҸжңҖеӨҡзҡ„е…ғзҙ гҖӮдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү AпјҺYдёҖе®ҡжҳҜйқһйҮ‘еұһе…ғзҙ BпјҺеҺҹеӯҗеҚҠеҫ„пјҡr(X)<r(Y)<r(Z)<r(W) CпјҺWзҡ„жңҖй«ҳд»·ж°§еҢ–зү©еҜ№еә”зҡ„ж°ҙеҢ–зү©дёҖе®ҡжҳҜејәй…ё DпјҺиӢҘYгҖҒZгҖҒWдҪҚдәҺзӣёйӮ»зҡ„дёүдёӘдё»ж—ҸпјҢYзҡ„ж°ўеҢ–зү©жІёзӮ№дёҖе®ҡдҪҺдәҺW
|
|
| 15. | иҜҰз»ҶдҝЎжҒҜ |
|
еёёжё©дёӢпјҢдёӢеҲ—еҗ„з»„зҰ»еӯҗеңЁжҢҮе®ҡжә¶ж¶ІдёӯиғҪеӨ§йҮҸе…ұеӯҳзҡ„жҳҜпјҲВ В пјү AпјҺж–°еҲ¶ж°Ҝж°ҙдёӯпјҡFe3+гҖҒMg2+гҖҒSO42-гҖҒ NO3- BпјҺеҗ«иҫғеӨҡ[Al(OH)4]- зҡ„жә¶ж¶ІдёӯпјҡK+гҖҒH+гҖҒBr-гҖҒS2- CпјҺc(Fe3+)=1molВ·L-1зҡ„жә¶ж¶ІдёӯпјҡK+гҖҒNH4+гҖҒCl-гҖҒI- DпјҺдҪҝзәўиүІзҹіи•ҠиҜ•зәёеҸҳи“қзҡ„жә¶ж¶ІдёӯпјҡNa+гҖҒCu2+гҖҒSO42-гҖҒNO3-
|
|
| 16. | иҜҰз»ҶдҝЎжҒҜ |
|
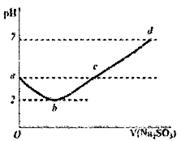
еёёжё©дёӢеҗ‘жҹҗжө“еәҰзҡ„ж–°еҲ¶ж°Ҝж°ҙдёӯйҖҗж»ҙеҠ е…ҘNa2SO3жә¶ж¶ІпјҢжә¶ж¶ІpH еҸҳеҢ–еҰӮеӣҫжүҖзӨәпјҲж•ҙдёӘиҝҮзЁӢдёӯж— ж°”дҪ“йҖёеҮәпјүпјҢдёӢеҲ—е…ізі»жӯЈзЎ®зҡ„жҳҜпјҲВ В пјү
AпјҺaзӮ№пјҡc(H+)=c(Cl-)+c(OH-) BпјҺbзӮ№пјҡc(Cl-)=0.005molВ·L-1 CпјҺcзӮ№пјҡc(Na+)=2c(HSO3-)+2c(SO32-)+2c(SO42-)+2c(H2SO3) DпјҺd зӮ№пјҡc(Na+)>c(Cl-)>2c(SO32-)+C(HSO3-)+2c(SO42-)
|
|
| 17. | иҜҰз»ҶдҝЎжҒҜ |
|
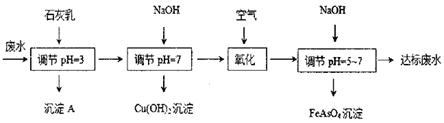
жҹҗзЎ«й…ёе·ҘеҺӮзҡ„еәҹж°ҙдёӯеҗ«жңүиҫғеӨҡзҡ„H+гҖҒCu2+гҖҒFe2+гҖҒSO42-гҖҒAsO43-гҖҒHAsO42-гҖҒ H2AsO4-зӯүйңҖиҰҒеӨ„зҗҶзҡ„жқӮиҙЁзҰ»еӯҗпјҢе…¶дёӯдёҖз§ҚеӨ„зҗҶжөҒзЁӢеҰӮеӣҫжүҖзӨә
е·ІзҹҘпјҡKsp[Cu(OH)2]=2.2Г—10-20пјҢKsp[Fe(OH)2]=8.6Г—10-16пјӣH3AsO4дёәејұй…ёгҖӮ пјҲ1пјүжІүж·ҖAзҡ„дё»иҰҒжҲҗеҲҶзҡ„еҢ–еӯҰејҸжҳҜВ В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүеёёжё©дёӢpH=7зҡ„жә¶ж¶ІдёӯCu2+зҡ„зү©иҙЁзҡ„йҮҸжө“еәҰдёәВ В В В В В пјҢжӯӨж—¶Fe2+жҳҜеҗҰжІүж·Җе®Ңе…ЁВ В В В В В пјҲеЎ«вҖңжҳҜвҖқжҲ–вҖңеҗҰвҖқ)гҖӮ пјҲ3пјүиӢҘж°§еҢ–иҝҮзЁӢдёӯз”ҹжҲҗдәҶжҹҗз§Қиғ¶дҪ“пјҢз”ЁзҰ»еӯҗж–№зЁӢејҸи§ЈйҮҠж°§еҢ–иҝҮзЁӢдёӯжә¶ж¶ІpHйҷҚдҪҺзҡ„еҺҹеӣ В В В В В В В В В гҖӮ пјҲ4пјүжңҖеҗҺдёҖж¬Ўи°ғиҠӮpHж—¶pHиҝҮдҪҺжҲ–иҝҮй«ҳз ·зҡ„еҺ»йҷӨзҺҮйғҪдјҡжҳҺжҳҫйҷҚдҪҺпјҢpHиҝҮдҪҺж—¶еҸҜиғҪзҡ„еҺҹеӣ жҳҜВ В В В В В В пјҲд»Һе№іиЎЎи§’еәҰи§ЈйҮҠ)пјӣpHиҝҮй«ҳж—¶еҸҜиғҪзҡ„еҺҹеӣ жҳҜВ В В В В В В В В В В В В В В В пјҲд»ҺжІүж·ҖиҪ¬еҢ–зҡ„и§’еәҰи§ЈйҮҠпјүгҖӮ пјҲ5пјүзЎ«еҢ–жі•жҳҜеҸҰдёҖз§ҚеӨ„зҗҶеҗ«з ·еәҹж°ҙзҡ„ж–№жі•пјҢж¶үеҸҠзҡ„еҸҚеә”жңү Na2S+H2SO4 2H3AsO3+3H2S As2S3+H2SO4(жө“) еңЁеҸҚеә”в‘ е’Ңв‘ўдёӯпјҢзЎ«й…ёиЎЁзҺ°еҮәзҡ„жҖ§иҙЁдҫқж¬ЎжҳҜВ В В В В В гҖҒВ В В В В В гҖӮ
|
|
| 18. | иҜҰз»ҶдҝЎжҒҜ |
|
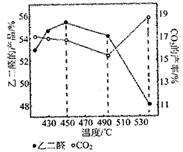
д№ҷдәҢйҶӣпјҲOHC-CHO)жҳҜзәәз»Үе·Ҙдёҡеёёз”Ёзҡ„дёҖз§ҚжңүжңәеҺҹж–ҷпјҢе…¶е·Ҙдёҡз”ҹдә§ж–№жі•дё»иҰҒжҳҜд№ҷдәҢйҶҮпјҲHOCH2CH2OH)ж°”зӣёеӮ¬еҢ–ж°§еҢ–жі•е’Ңд№ҷйҶӣж¶ІзӣёзЎқй…ёж°§еҢ–жі•пјҢиҜ·еӣһзӯ”дёӢеҲ—зӣёе…ій—®йўҳгҖӮ пјҲ1пјүд№ҷдәҢйҶҮж°”зӣёеӮ¬еҢ–ж°§еҢ–жі• в‘ д№ҷдәҢйҶҮж°”зӣёеӮ¬еҢ–ж°§еҢ–зҡ„еҸҚеә”дёә HOCH2CH2OH(g)+O2(g)F5 е·ұзҹҘ OHC-CHO(g)+2H2 H2(g)+l/2O2(g) еҲҷв–іH3= В В В В В В пјҲз”Ёв–іH1гҖҒв–іH2иЎЁзӨәпјүпјҢзӣёеҗҢжё©еәҰдёӢK1=В В В В В В пјҲз”ЁK2гҖҒK3иЎЁзӨәпјүгҖӮ в‘ЎеҪ“еҺҹж–ҷж°”дёӯж°§ж°”е’Ңд№ҷдәҢйҶҮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дёә1.35ж—¶пјҢд№ҷдәҢйҶӣе’ҢеүҜдә§зү©CO2зҡ„дә§зҺҮдёҺеҸҚеә”жё©еәҰзҡ„е…ізі»еҰӮдёӢеӣҫжүҖзӨәпјҢеҸҚеә”жё©еәҰи¶…иҝҮ495в„ғж—¶пјҢCO2дә§зҺҮеҚҮй«ҳзҡ„дё»иҰҒеҺҹеӣ еҸҜиғҪжҳҜВ В В В В В В В В В В гҖӮ
в‘ўеңЁжҒ’е®№з»қзғӯе®№еҷЁдёӯеҸ‘з”ҹеҸҚеә”HOCH2CH2OH(g)+O2(g) AпјҺж°§ж°”жө“еәҰдҝқжҢҒдёҚеҸҳ В В В В В В В В В В В BпјҺж°”дҪ“жҖ»зү©иҙЁзҡ„йҮҸдҝқжҢҒдёҚеҸҳ CпјҺе№іиЎЎеёёж•°дҝқжҢҒдёҚеҸҳ В В В В В В В В В В В DпјҺж°§ж°”е’Ңд№ҷдәҢйҶҮзҡ„зү©иҙЁзҡ„йҮҸд№ӢжҜ”дҝқжҢҒдёҚеҸҳ пјҲ2пјүд№ҷйҶӣж¶ІзӣёзЎқй…ёж°§еҢ–жі• д№ҷйҶӣж¶ІзӣёзЎқй…ёж°§еҢ–жі•жҳҜеңЁеӮ¬еҢ–еүӮзҡ„дҪңз”ЁдёӢпјҢз”ЁзЁҖзЎқй…ёж°§еҢ–д№ҷйҶӣеҲ¶еҸ–д№ҷдәҢйҶӣпјҢиҜҘжі•дёҺд№ҷдәҢйҶҮж°”зӣё еӮ¬еҢ–ж°§еҢ–жі•зӣёжҜ”жҳҺжҳҫзҡ„зјәзӮ№жҳҜВ В В В В В В В В В В В В В В В В гҖӮпјҲд»»еҶҷдёҖжқЎпјү пјҲ3пјүд№ҷдәҢйҶӣз”өи§Јж°§еҢ–еҲ¶еӨҮд№ҷйҶӣй…ёпјҲOHC-COOH)зҡ„з”ҹдә§иЈ…зҪ®еҰӮдёӢеӣҫжүҖзӨәпјҢйҖҡз”өеҗҺпјҢйҳіжһҒдә§з”ҹзҡ„Cl2дёҺд№ҷдәҢйҶӣжә¶ж¶ІеҸҚеә”з”ҹжҲҗд№ҷйҶӣй…ёпјҢиҜ·еҶҷеҮәиҜҘеҸҚеә”зҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В гҖӮ
пјҲдәҢпјүйҖүиҖғйўҳпјҲе…ұ12еҲҶпјү иҜ·иҖғз”ҹд»Һ20гҖҒ21йўҳдёӯд»»йҖүдёҖйўҳдҪңзӯ”пјҢ并用2B铅笔еңЁзӯ”йўҳеҚЎдёҠжҠҠжүҖйҖүйўҳзӣ®зҡ„йўҳеҸ·ж¶Ӯй»‘пјҢжіЁж„ҸжүҖеҒҡйўҳзӣ®зҡ„йўҳеҸ·еҝ…йЎ»дёҺжүҖж¶Ӯйўҳзӣ®зҡ„йўҳеҸ·дёҖиҮҙпјҢеңЁзӯ”йўҳеҚЎйҖүзӯ”еҢәеҹҹжҢҮе®ҡдҪҚзҪ®зӯ”йўҳпјҢеҰӮжһңеӨҡеҒҡпјҢеҲҷжҢүжүҖеҒҡзҡ„第дёҖйўҳи®ЎеҲҶгҖӮ
|
|
| 19. | иҜҰз»ҶдҝЎжҒҜ |
|
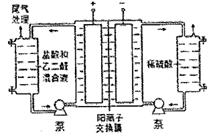
дёүж°ҜеҢ–е…ӯж°ЁеҗҲй’ҙ[Co(NH3)6]Cl3жҳҜдёҖз§ҚйҮҚиҰҒзҡ„еҢ–е·Ҙдә§е“ҒпјҢе®һйӘҢе®ӨйҖҡеёёжҳҜеңЁNH3е’ҢNH4ClеӯҳеңЁжқЎд»¶дёӢпјҢд»Ҙжҙ»жҖ§зӮӯдёәеӮ¬еҢ–еүӮпјҢз”ЁH2O2ж°§еҢ–CoC12жә¶ж¶ІжқҘеҲ¶еӨҮ[Co(NH3)6]Cl3пјҢиҜҘеҸҚеә”еұһдәҺеӨ§йҮҸж”ҫзғӯзҡ„еҸҚеә”гҖӮжҹҗе°Ҹз»„з”ЁеҰӮеӣҫжүҖзӨәиЈ…зҪ®еҲ¶еӨҮ[Co(NH3)6]Cl3пјҢе®һйӘҢжӯҘйӘӨеҰӮдёӢпјҡ
в… пјҺз§°еҸ–з ”з»Ҷзҡ„CoC12В·6H2OзІүжң«10.0gе’ҢNH4Cl5.0gдәҺзғ§жқҜдёӯ并еҠ ж°ҙжә¶и§ЈпјҢе°Ҷжә¶ж¶ІиҪ¬е…ҘдёүйўҲзғ§з“¶пјҢеҠ е…Ҙ25mLжө“ж°Ёж°ҙе’ҢйҖӮйҮҸжҙ»жҖ§зӮӯзІүжң«пјҢйҖҗж»ҙеҠ е…Ҙ5mL30%зҡ„H2O2жә¶ж¶ІгҖӮ в…ЎпјҺз”Ёж°ҙжөҙе°Ҷж··еҗҲзү©еҠ зғӯиҮі60в„ғпјҢжҒ’жё©20еҲҶй’ҹпјҢ然еҗҺз”ЁеҶ°ж°ҙжөҙеҶ·еҚҙпјҢе……еҲҶз»“жҷ¶еҗҺиҝҮж»ӨгҖӮ в…ўпјҺе°ҶжІүж·Җжә¶дәҺзғӯзҡ„зӣҗй…ёдёӯпјҢи¶ҒзғӯиҝҮж»ӨпјҢж»Өж¶ІдёӯеҠ йҖӮйҮҸжө“зӣҗ酸并еҶ·еҚҙз»“жҷ¶гҖӮ в…ЈпјҺиҝҮж»ӨгҖҒз”Ёд№ҷйҶҮжҙ—ж¶Өжҷ¶дҪ“并еңЁ105в„ғжқЎд»¶дёӢзғҳе№ІгҖӮ иҜ•еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ пјҲ1пјүеҲ¶еӨҮ[Co(NH3)6]Cl3зҡ„еҢ–еӯҰж–№зЁӢејҸжҳҜВ В В В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ2пјүиҜ·жҢҮеҮәиЈ…зҪ®дёӯеӯҳеңЁзҡ„дёҖеӨ„зјәйҷ·В В В В В В В В В В В В В В В В В В В гҖӮ пјҲ3пјүиӢҘе°Ҷ5mL30%зҡ„H2O2жә¶ж¶ІдёҖж¬ЎжҖ§еҠ е…ҘдёүйўҲзғ§з“¶пјҢдјҡеҮәзҺ°зҡ„й—®йўҳжҳҜВ В В В В В В В В В В В В В гҖӮ пјҲ4пјүиӢҘж— жҙ»жҖ§зӮӯдҪңеӮ¬еҢ–еүӮпјҢжүҖеҫ—дә§зү©дёӯйҷӨ[Co(NH3)6]Cl3еӨ–иҝҳдјҡжңүеӨ§йҮҸдәҢж°ҜеҢ–дёҖж°Ҝдә”ж°ЁеҗҲй’ҙ[Co(NH3)5]Cl3е’Ңдёүж°ҜеҢ–дә”ж°ЁдёҖж°ҙеҗҲй’ҙ[Co(NH3)5]Cl3жҷ¶дҪ“пјҢиҖҢеңЁжҙ»жҖ§зӮӯзҡ„еӮ¬еҢ–дҪңз”ЁдёӢпјҢдё»иҰҒдә§зү©еҸӘжңү[Co(NH3)6]Cl3пјҢиҝҷдҪ“зҺ°дәҶеӮ¬еҢ–еүӮзҡ„В В В В В В В жҖ§гҖӮ пјҲ5пјүжӯҘйӘӨв…ўдёӯи¶ҒзғӯиҝҮж»Өзҡ„дё»иҰҒзӣ®зҡ„жҳҜВ В В В В В В В В В В В пјҢж»Өж¶ІдёӯеҠ йҖӮйҮҸжө“зӣҗй…ёзҡ„дё»иҰҒзӣ®зҡ„жҳҜВ В В В В В В В гҖӮ пјҲ6пјүд№ҷйҶҮжҙ—ж¶ӨдёҺи’ёйҰҸж°ҙжҙ—ж¶ӨзӣёжҜ”дјҳзӮ№жҳҜВ В В В В В В В В В В В В В В В В В гҖӮ
|
|
| 20. | иҜҰз»ҶдҝЎжҒҜ |
|
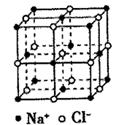
пјҲ1пјүеҹәжҖҒеҺҹеӯҗеҸҳжҲҗжҝҖеҸ‘жҖҒеҺҹеӯҗдә§з”ҹзҡ„е…үи°ұеҸ«В В В В В В е…үи°ұгҖӮ第еӣӣе‘ЁжңҹдёӯеҹәжҖҒеҺҹеӯҗзҡ„MеұӮз”өеӯҗе…Ёж»Ўзҡ„е…ғзҙ дҪҚдәҺе‘ЁжңҹиЎЁзҡ„В В В В В В еҢәпјҢе…¶дёӯжңӘжҲҗеҜ№з”өеӯҗж•°дёә1зҡ„жңүВ В В В В В з§ҚгҖӮ пјҲ2пјүе·ІзҹҘж¶ІжҖҒдәҢж°§еҢ–зЎ«еҸҜд»ҘеҸ‘з”ҹзұ»дјјдәҺж°ҙзҡ„иҮӘиә«з”өзҰ»2SO2(l) пјҲ3пјүж°ҜеҢ–й’ зҡ„жҷ¶иғһеҰӮеӣҫжүҖзӨәпјҢй’ зҰ»еӯҗе‘Ёеӣҙзҙ§йӮ»зҡ„ж°ҜзҰ»еӯҗеҪўжҲҗзҡ„еҮ дҪ•жһ„еһӢжҳҜВ В В В В В гҖӮиӢҘй’ зҰ»еӯҗе’Ңж°ҜзҰ»еӯҗзҡ„еҚҠеҫ„еҲҶеҲ«жҳҜapmе’ҢbpmпјҢеҲҷж°ҜеҢ–й’ жҷ¶дҪ“зҡ„з©әй—ҙеҲ©з”ЁзҺҮжҳҜВ В В В В В гҖӮ
|
|
| 21. | иҜҰз»ҶдҝЎжҒҜ |
|
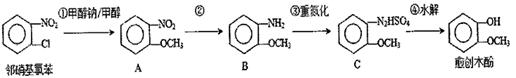
ж„ҲеҲӣжңЁй…ҡжҳҜйҰҷж–ҷгҖҒеҢ»иҚҜгҖҒеҶңиҚҜзӯүе·Ҙдёҡзҡ„йҮҚиҰҒзҡ„зІҫз»ҶеҢ–е·Ҙдёӯй—ҙдҪ“пјҢе·ҘдёҡдёҠд»ҘйӮ»зЎқеҹәж°ҜиӢҜдёәеҺҹж–ҷеҗҲжҲҗж„ҲеҲӣжңЁй…ҡзҡ„дёҖз§ҚжөҒзЁӢеҰӮдёӢеӣҫжүҖзӨәгҖӮ
пјҲ1пјүеҸҚеә”в‘ в‘Ўзҡ„зұ»еһӢдҫқж¬ЎжҳҜВ В В В В В В В гҖҒВ В В В В В В В В гҖӮ пјҲ2пјүBзү©иҙЁдёӯзҡ„е®ҳиғҪеӣўеҗҚз§°жҳҜВ В В В В В В В гҖӮ пјҲ3пјүCзү©иҙЁзҡ„еҲҶеӯҗејҸжҳҜВ В В В В В В В В гҖӮ пјҲ4пјүе·ІзҹҘCзү©иҙЁж°ҙи§Јдә§зү©д№ӢдёҖжҳҜж°®ж°”пјҢеҶҷеҮәеҸҚеә”в‘Јзҡ„еҢ–еӯҰж–№зЁӢејҸВ В В В В В В В В В В В В В В гҖӮпјҲдёҚиҰҒжұӮеҶҷжқЎд»¶пјү пјҲ5пјүж„ҲеҲӣжңЁй…ҡзҡ„еҗҢеҲҶејӮиҙӯдҪ“дёӯеұһдәҺиҠійҰҷеҢ–еҗҲзү©дё”еҗ«жңүдёүдёӘеҸ–д»ЈеҹәжңүВ В В В В В з§ҚпјҢе…¶дёӯеҗ«жңүж°ўеҺҹеӯҗз§Қзұ»жңҖе°‘зҡ„зү©иҙЁзҡ„з»“жһ„з®ҖејҸжҳҜВ В В В В В гҖӮ
|
|
- йӣ·еұұеҺҝ第еӣӣдёӯеӯҰй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•еҲ·йўҳи®ӯз»ғ
- е®ҒеӨҸе№ізҪ—дёӯеӯҰе®Ңж•ҙиҜ•еҚ·
- еҙҮе·ҰеёӮй«ҳдәҢеҢ–еӯҰдёҠеҶҢжңҹжң«иҖғиҜ•йўҳе…Қиҙ№иҜ•еҚ·
- 2019-2020е№ҙй«ҳдёҖ12жңҲжңҲиҖғеҢ–еӯҰйўҳејҖеҚ·жңүзӣҠпјҲж№–еҚ—зңҒйӮөйҳіеёӮеҸҢжё…еҢәеҚҒдёҖдёӯпјү
- жІіеҚ—зңҒиұ«еҚ—д№қж Ў2020-2021е№ҙй«ҳдәҢдёҠеӯҰжңҹ第еӣӣж¬ЎиҒ”иҖғеҢ–еӯҰзҪ‘дёҠжЈҖжөӢж— зәёиҜ•еҚ·еёҰзӯ”жЎҲе’Ңи§Јжһҗ
- й»‘йҫҷжұҹзңҒеӨ§е…ҙе®үеІӯе‘јзҺӣеҺҝй«ҳзә§дёӯеӯҰ2020-2021е№ҙй«ҳдёҖеүҚеҚҠжңҹ第дёүж¬ЎжңҲиҖғеҢ–еӯҰеңЁзәҝиҖғиҜ•йўҳе…Қиҙ№з»ғд№
- й»‘йҫҷжұҹзңҒеӨ§е…ҙе®үеІӯжј жІіеҺҝ第дёҖдёӯеӯҰ2020еұҠй«ҳдёүеүҚеҚҠжңҹжңҲиҖғеҢ–еӯҰе…Қиҙ№иҜ•еҚ·е®Ңж•ҙзүҲ
- еұұдёңзңҒжөҺеҚ—еёӮ2020-2021е№ҙй«ҳдәҢ1жңҲеӯҰжғ…иҜҠж–ӯеҢ–еӯҰеңЁзәҝжөӢйӘҢе®Ңж•ҙзүҲ